题目内容
18.下列离子方程式正确的是( )| A. | 铜和稀硝酸的反应:Cu2++4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 氯气与水反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
分析 A.不符合反应客观事实;
B.电荷不守恒;
C.一水合氨为弱电解质,应保留化学式;
D.二氧化锰与浓盐酸加热生成氯气、氯化锰和水.
解答 解:A.铜和稀硝酸的反应,离子方程式:3Cu2++8H++2NO3-═3Cu2++2NO↑+4H2O,故A错误;
B.氯气与水反应,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.氯化铝溶液加入氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.实验室制氯气,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故D正确;
故选:D.
点评 本题考查离子方程式的书写,本题注意水、氨水都为弱电解质,应写成化学式,书写离子方程式时要注意电荷守恒、质量守恒,题目难度不大.

练习册系列答案
相关题目
6.常温下,下列各组物质不能用一种试剂通过化学反应鉴别的是( )
| A. | FeCl2 MgCl2 AlCl3 | B. | AgNO3KNO3 Na2CO3 | ||
| C. | NH4Cl (NH4)2SO4 K2SO4 | D. | Na2CO3 NaHCO3K2CO3 |
13.常温下,往H2O2溶液中滴加少量FeSO4溶液,可反生如下两个反应:2Fe2++H2O2+2H+═2Fe3++2H2O;2Fe3++H2O2═2Fe2++O2+2H+下列说法正确的是( )
| A. | H2O2的氧化性比Fe3+强,其还原性比Fe2+强 | |
| B. | 在该实验中,最终溶液仍为无色 | |
| C. | 在该实验中,Fe2+和Fe3+总量保持不变 | |
| D. | H2O2值能的电子,不能失电子 |
3.下列实验操作中正确的是( )
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,上层液体从下口放出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
7.下列说法正确的是( )
| A. | 新制氯水、氨水的溶质分别是次氯酸、一水合氨 | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 物质溶于水时,不一定发生化学键的断裂 | |
| D. | 烧碱、冰醋酸、四氯化碳均为电解质 |




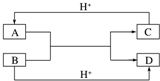 (1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D的结构式:H-O-H.
;D的结构式:H-O-H.
