题目内容
7.二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用水煤气合成二甲醚,总反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol(1)该反应的化学平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}({H}_{2}){c}^{3}(CO)}$.温度升高平衡常数变小(填“变大”、“变小”、“不变”)
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是cd(填字母代号).
a.降低温度 b.加入催化剂 c.缩小容器体积
d.增加H2的浓度 e.增加CO的浓度
(3)在一定温度下,在容积为1L的密闭容器中充入3mol H2、3mol CO,发生反应:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),在10min时刚好达到平衡,此
时测得H2的物质的量浓度为1.5mo1•L-1.则:
①衡时n(CH3OCH3)=0.5,平衡时CO的转化率为50%.
②达到平衡后,若向容器中再充入1mol H2、1mol CO2,经一定时间达到平衡,反应开始时正、逆反应速率的大小:v(正)> v(逆)(填“>”“<”或“=”).
③在该反应条件下能判断反应达到化学平衡状态的依据是D(填编号).
A.v(CO)=3v(CO2) B.生成a mol CO2的同时消耗3a mol H2
C.c(CO2)=c(CO) D.混合气体的平均相对分子质量不变
E.气体的密度不再改变 F.气体的总质量不再改变.
分析 (1)依据平衡常数概念写出表达式;因反应是放热反应,升温,平衡逆向进行,平衡常数减小;
(2)改变条件增大反应速率,可以采取加入催化剂、升温、加压、增大浓度等措施,且提高CO的转化率应使平衡向正反应方向移动,结合平衡移动原理分析解答;
(3)①在一定温度下,在容积为1L的密闭容器中充入3mol H2、3mol CO,发生反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),在10min时刚好达到平衡,此时测得H2的物质的量浓度为1.5mo1•L-1.物质的量1.5mo1•L-1×1L=1.5mol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)
起始量(mol) 3 3 0 0
变化量(mol) 1.5 1.5 0.5 0.5
平衡量(mol) 1.5 1.5 0.5 0.5
转化率=$\frac{消耗量}{起始量}$×100%;
②依据①计算平衡常数,计算此时的浓度商和平衡常数比较大小判断反应进行的方向;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)该反应的平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}({H}_{2}){c}^{3}(CO)}$,因反应是放热反应,升温,平衡逆向进行,平衡常数减小,故答案为:$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}({H}_{2}){c}^{3}(CO)}$;变小;
(2)a.正反应为放热反应,降低温度,平衡向正反应方向移动,CO的转化率增大,但反应速率减小,故a错误;
b.加入催化剂,反应速率增大,不影响平衡移动,CO的转化率不变,故b错误;
c.正反应为气体体积减小的反应,缩小容器体积,压强增大,反应速率增大,平衡向正反应方向移动,CO的转化率增大,故c正确;
d.增加H2的浓度,反应速率增大,平衡向正反应移动,CO的转化率增大,故d正确;
e.增加CO的浓度,反应速率增大,平衡向正反应移动,但CO的转化率减小,故e错误;
故答案为:cd;
(3)①在一定温度下,在容积为1L的密闭容器中充入3mol H2、3mol CO,发生反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),在10min时刚好达到平衡,此时测得H2的物质的量浓度为1.5mo1•L-1.物质的量1.5mo1•L-1×1L=1.5mol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)
起始量(mol) 3 3 0 0
变化量(mol) 1.5 1.5 0.5 0.5
平衡量(mol) 1.5 1.5 0.5 0.5
衡时n(CH3OCH3)=0.5mol,
平衡时CO的转化率=$\frac{1.5mol}{3mol}$×100%=50%,
故答案为:0.5;50%;
②平衡常数K=$\frac{0.5×0.5}{1.{5}^{3}×1.{5}^{3}}$=0.022,达到平衡后,若向容器中再充入1mol H2、1mol CO2,Qc=$\frac{1.5×0.5}{2.{5}^{3}×1.{5}^{3}}$=0.014<K,反应正向进行,v(正)>v(逆),
故答案为:>;
③A.反应速率之比等于化学方程式计量数之比,在任何时候,反应速率v(CO)=3v(CO2),不能证明反应达到平衡状态,故A错误;
B.在任何时候,生成amolCO2的同时消耗3amolH2,说明反应正向进行,不能证明反应达到平衡状态,故B错误;
C.c(CO2)=c(CO),和起始量、变化量有关,不能证明反应达到平衡状态,故C错误;
D.反应前后气体质量不变,气体物质的量减小,反应过程中混合气体的平均相对分子质量不变,说明反应达到平衡状态,故D正确;
E.体积不变的密闭容器中,气体质量不变,体积不发生变化,所以气体的密度始终不变,不能说明反应达到平衡状态,故E错误;
F.密闭容器中气体质量始终不变,所以气体的总质量不再改变,不能说明反应达到平衡状态,故F错误;
故答案为:D.
点评 本题考查反应热计算、化学平衡影响因素、化学平衡计算等,难度中等,注意平衡常数和浓度商比较判断反应进行方向的方法.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案| A. | H2O2的氧化性比Fe3+强,其还原性比Fe2+强 | |
| B. | 在该实验中,最终溶液仍为无色 | |
| C. | 在该实验中,Fe2+和Fe3+总量保持不变 | |
| D. | H2O2值能的电子,不能失电子 |
| A. | 发生的化学反应是复分解反应 | |
| B. | 反应的生成物中有Na2CO3 | |
| C. | 反应后形成的混合物的聚集颗粒直径为1~100nm | |
| D. | 反应说明硅酸易溶于水 |
CO(g)+2H2(g)?CH3OH(g)
①下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
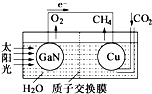 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |
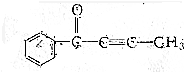 的有机化合物分子中:
的有机化合物分子中:
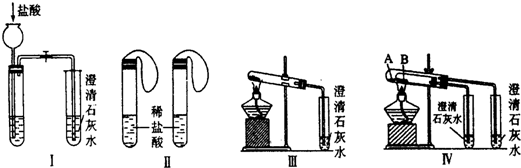
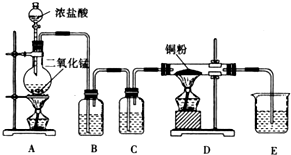 某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.