题目内容
1.如图各容器中盛有海水铁在其中被腐蚀时由快到慢的顺序是( )
| A. | ④>②>①>③ | B. | ①>④>②>③ | C. | ④>②>③>① | D. | ③>②>④>① |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢和电解池的阴阳极腐蚀快慢来比较,从而确定腐蚀快慢顺序,电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,③④装置是原电池,在④中,金属铁做负极,③中金属铁作正极,被保护而不内腐蚀,而②发生化学腐蚀,速率较慢,做负极的腐蚀速率快,所以④>>②>③,①装置是电解池,其中金属铁为阳极,腐蚀速率最快,所以腐蚀速率是:①>④>②>③,
故选B.
点评 本题考查了金属腐蚀快慢判断,为高频考点,明确铁发生的腐蚀类型及作何种电极即可解答,利用金属腐蚀与防护,采取合适措施防止铁被腐蚀,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列说法正确的是( )
| A. | 新制氯水、氨水的溶质分别是次氯酸、一水合氨 | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 物质溶于水时,不一定发生化学键的断裂 | |
| D. | 烧碱、冰醋酸、四氯化碳均为电解质 |
9.在容量瓶的使用方法中,下列操作正确的是( )
| A. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| D. | 使用容量瓶前检查它是否漏水 |
6.现有下列物质:①Na2CO3 ②铜 ③氯化氢 ④CO2⑤NaHSO4 ⑥Ba(OH)2
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
(2)物质⑨的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为O2+4I-+2H2O═2I2+4OH-.
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
10.下列实验装置图合理的是( )
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 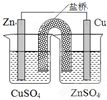 装置能构成锌铜原电池 | |
| C. | 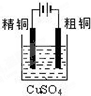 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
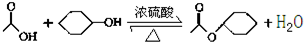
11. 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
实验步骤:
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
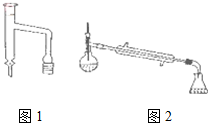
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.

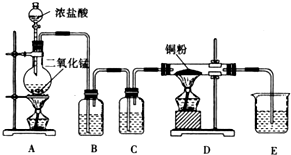 某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.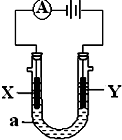 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: