题目内容
13.下列反应属于吸热反应的是( )| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 铝热反应 |
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应、食物腐败、炸药爆炸等;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),Ba(OH)2•8H2O和NH4Cl反应.
解答 解:A.石灰石在高温下的分解反应,是吸热反应,故A正确;
B.金属钠和水反应放出大量的热,是放热反应,故B错误;
C.盐酸与氢氧化钠溶液的反应是中和反应,是放热反应,故C错误;
D.铝热反应是放热反应,故D错误;
故选A.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应类型是解题的关键,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4. 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
1.某化学小组以苯甲酸为原料制取苯甲酸甲酯.已知有关物质的沸点和相对分子质量如表:
实验过程及实验装置如图:

(提示:苯甲酸甲酯粗产品往往含有少量甲醇、硫酸、苯甲酸和水等)
(1)简述第一步混合液体时,最后加入浓硫酸的理由是浓硫酸密度较大,且易于苯甲酸、甲醇混合放出大量热量,甲醇易挥发.若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式 .
.
(2)反应物CH3OH应过量,理由是该反应是可逆反应,增加甲醇的量,使平衡向右移动,有利于提高苯甲酸的转化率.
(3)分液时上层液体从分液漏斗的上口出来,接受馏分时温度控制在199.6℃左右.
(4)以上流程图中加入Na2CO3的作用是通过反应消耗硫酸、苯甲酸,降低苯甲酸甲酯的溶解度.
(5)通过计算,苯甲酸甲酯的产率为65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

(提示:苯甲酸甲酯粗产品往往含有少量甲醇、硫酸、苯甲酸和水等)
(1)简述第一步混合液体时,最后加入浓硫酸的理由是浓硫酸密度较大,且易于苯甲酸、甲醇混合放出大量热量,甲醇易挥发.若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
 .
.(2)反应物CH3OH应过量,理由是该反应是可逆反应,增加甲醇的量,使平衡向右移动,有利于提高苯甲酸的转化率.
(3)分液时上层液体从分液漏斗的上口出来,接受馏分时温度控制在199.6℃左右.
(4)以上流程图中加入Na2CO3的作用是通过反应消耗硫酸、苯甲酸,降低苯甲酸甲酯的溶解度.
(5)通过计算,苯甲酸甲酯的产率为65%.
8.X、Y、Z、W为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与W同周期,W的原子半径小于Z.下列叙述正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
18.下列有机反应属于加成反应的是( )
| A. | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
3.铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30%H2SO4,下图是处于工作状态的铅蓄电池示意图,若两电极的质量增加且a极增加得更多.下列说法正确的是( )

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
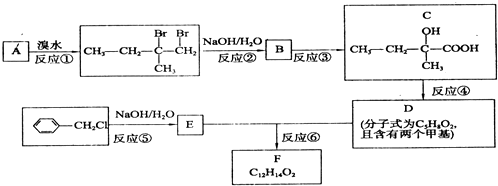
 .
.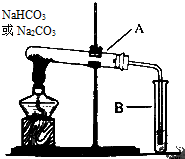 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案. 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: