题目内容
 某环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
某环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.(1)在如图1中所示仪器中,配制上述溶液不需要的是
(2)根据计算,下列量程或规格中,本实验量筒应使用的是
A.10mL B.100mL C.250mL D.500mL
(3)若定容后摇匀静置,发现凹液面低于刻度线,此时应该
A.直接转移到细口试剂瓶中
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制
D.直接贮存于容量瓶中
(4)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1mol?L-1)如何(a.偏高;b.偏低; c.无影响,在下面的横线上填相应序号).
①容量瓶中有少量蒸馏水
②烧杯和玻璃棒没有洗涤2~3次
③定容时俯视
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制一定物质的量浓度的溶液使用的仪器分析需要的仪器和缺少的仪器;再根据玻璃棒在操作中的作用解答;
(2)根据c=
计算出需要浓盐酸的浓度,再根据配制250mL 0.1mol?L-1的盐酸溶液需要的氯化氢的物质的量计算出需要的体积;配制250mL溶液需要250mL容量瓶;
(3)若定容后摇匀静置,发现凹液面低于刻度线,此时应该直接转移到细口试剂瓶中;
(4)根据c=
,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值小或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据c=
| 1000ρw |
| M |
(3)若定容后摇匀静置,发现凹液面低于刻度线,此时应该直接转移到细口试剂瓶中;
(4)根据c=
| n |
| V |
解答:
解:(1)分液漏斗用来萃取和分液,配制一定物质的量浓度溶液不用分液漏斗,故选C;还缺少玻璃棒,在浓盐酸稀释时用玻璃棒搅拌,转移液体时用玻璃棒引流,
故答案为:C;玻璃棒;
(2)质量分数为37%的浓盐酸(密度为1.19g/cm3)的物质的量浓度为:c=
=
=12.1(mol/L),
所需浓盐酸体积V=
=0.0021L=2.1mL,故选择10mL量筒,配制250mL溶液,应选择250mL的容量瓶,
故答案为:A;C;
(3)由于摇匀后,在容量瓶的刻度线上方有部分溶液,所以溶液液面会低于刻度线,不需要专门处理,可以将配制的溶液直接转移到细口试剂瓶中,
故选A;
(4)①溶液配制需加水定容,洗涤后的容量瓶中残留少量蒸馏水,随所配溶液浓度无影响,故选c;
②没有洗涤烧杯和玻璃棒,移入容量瓶内溶质的质量偏小,所配溶液的浓度偏低,故选b;
③定容时,俯视刻度线,液面在刻度线下方,溶液的体积偏小,所配溶液的浓度偏高,故选a.
故答案为:C;玻璃棒;
(2)质量分数为37%的浓盐酸(密度为1.19g/cm3)的物质的量浓度为:c=
| 1000ρw |
| M |
| 1000×1.19×37% |
| 36.5 |
所需浓盐酸体积V=
| 0.1mol/L×0.25L |
| 12.1mol/L |
故答案为:A;C;
(3)由于摇匀后,在容量瓶的刻度线上方有部分溶液,所以溶液液面会低于刻度线,不需要专门处理,可以将配制的溶液直接转移到细口试剂瓶中,
故选A;
(4)①溶液配制需加水定容,洗涤后的容量瓶中残留少量蒸馏水,随所配溶液浓度无影响,故选c;
②没有洗涤烧杯和玻璃棒,移入容量瓶内溶质的质量偏小,所配溶液的浓度偏低,故选b;
③定容时,俯视刻度线,液面在刻度线下方,溶液的体积偏小,所配溶液的浓度偏高,故选a.
点评:本题考查一定物质的量浓度溶液的配制,难度不大,注意理解溶液配制的原理.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
用电石浆(主要成分是CaO、SiO2、Al2O3、Fe2O3、MgO、CaS 和其它不溶于酸的物质)生产无水CaCl2,工艺流程如下(已知氯化钙晶体的化学式是:CaCl2?6H2O),下列有关说法不正确的是( )
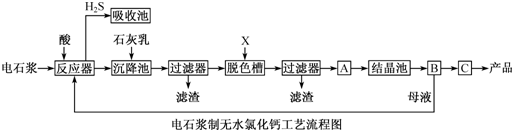

| A、反应器中加入的酸只能是盐酸 |
| B、脱色槽中应加入的X是为了脱色,所以可以选择活性炭或者过氧化钠 |
| C、氯化钙晶体CaCl2?6H2O可以直接脱水干燥得到无水CaCl2,无需在氯化氢的氛围下进行 |
| D、对设备B中产生的母液重新引入反应器,可以降低废弃物排放量,提高经济效益 |
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
| A、Ca2+、Na+、NO3-、CO32- |
| B、Mg2+、Cl-、NH4+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe3+、NO3- |