题目内容
用电石浆(主要成分是CaO、SiO2、Al2O3、Fe2O3、MgO、CaS 和其它不溶于酸的物质)生产无水CaCl2,工艺流程如下(已知氯化钙晶体的化学式是:CaCl2?6H2O),下列有关说法不正确的是( )
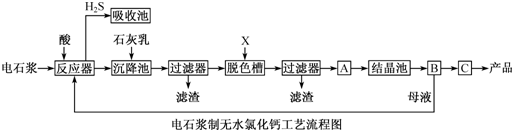

| A、反应器中加入的酸只能是盐酸 |
| B、脱色槽中应加入的X是为了脱色,所以可以选择活性炭或者过氧化钠 |
| C、氯化钙晶体CaCl2?6H2O可以直接脱水干燥得到无水CaCl2,无需在氯化氢的氛围下进行 |
| D、对设备B中产生的母液重新引入反应器,可以降低废弃物排放量,提高经济效益 |
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验题
分析:电石浆加入酸,CaO、Al2O3、Fe2O3、MgO、CaS溶于酸沉降后过滤得到滤渣为二氧化硅和不溶性杂质,加入活性炭脱色过滤后在A中蒸发浓缩得到晶体,B中过滤得到晶体,通过C脱水干燥得到产品,
A.因要生产的是CaCl2,所以应选用盐酸,不能用其它酸;
B.过氧化钠的强氧化性不能使氢氧化铁褪色;
C.CaCl2为强酸强碱盐,在加热的过程中不会发生水解反应;
D.设备B中产生的母液中含有氯化物,可以重新引入反应器中使用.
A.因要生产的是CaCl2,所以应选用盐酸,不能用其它酸;
B.过氧化钠的强氧化性不能使氢氧化铁褪色;
C.CaCl2为强酸强碱盐,在加热的过程中不会发生水解反应;
D.设备B中产生的母液中含有氯化物,可以重新引入反应器中使用.
解答:
解:A.因要生产CaCl2,过程中不引入新的杂质离子,所以应选用盐酸,故A正确;
B.过氧化钠不能使氢氧化铁等有色物质进行褪色,脱色槽中应加入的X不能是过氧化钠,故B错误;
C.CaCl2为强酸强碱盐,钙离子在溶液中不发生水解,所以加热氯化钙溶液可得到氯化钙,故C正确;
D.设备B中产生的母液中含有氯化物,通过回收利用,可以降低废弃物排放量,提高经济效益,故D正确;
故选B.
B.过氧化钠不能使氢氧化铁等有色物质进行褪色,脱色槽中应加入的X不能是过氧化钠,故B错误;
C.CaCl2为强酸强碱盐,钙离子在溶液中不发生水解,所以加热氯化钙溶液可得到氯化钙,故C正确;
D.设备B中产生的母液中含有氯化物,通过回收利用,可以降低废弃物排放量,提高经济效益,故D正确;
故选B.
点评:本题以“用电石浆可生产无水CaCl2”为载体,考查实验基本操作方法与技能,题目难度中等,试题涉及工艺流程的理解、物质分离提纯、元素化合物性质等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、NaCl |
| B、Fe(OH)3 |
| C、盐酸 |
| D、豆浆 |
体积为V mL,密度为ρ g?cm3的溶液,含有摩尔质量为M的溶质m g,其物质的量的浓度为c mol?L-1,溶质的质量分数为w%,则下列表达式正确的是( )
A、c=
| ||
B、m=V?ρ
| ||
C、w%=
| ||
D、c=
|
某同学在做中和热的测定实验时,有些操作不规范,造成测得中和热的数值偏高,请你分析可能的原因( )
| A、测量盐酸的温度后,温度计没有用水冲洗干净 |
| B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C、量取盐酸时仰视读数 |
| D、将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL0.55 mol/L的氨水 |


 某环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
某环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.