题目内容
元素周期表是学习化学的重要工具,它隐含许多信息和规律.下列元素:氧、镁、铝、硫、氯.
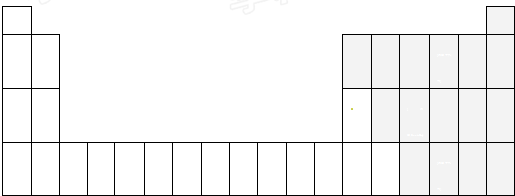
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
(2)铝原子的原子结构示意图为 ;
(3)比较这五种元素的原子半径从大到小: (填元素符号)
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是 (填化学式);
(5)镁、氯形成的化合物中含有 键.
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).

(2)铝原子的原子结构示意图为
(3)比较这五种元素的原子半径从大到小:
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是
(5)镁、氯形成的化合物中含有
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)根据原子电子层数、最外层电子数确定在周期表中的位置;
(2)铝原子核外有13个电子,分三层排布;
(3)电子层数越多,原子半径越大,电子层数相同时,原子序数越大,半径越小;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁.
(2)铝原子核外有13个电子,分三层排布;
(3)电子层数越多,原子半径越大,电子层数相同时,原子序数越大,半径越小;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁.
解答:
解:(1)O元素位于第二周期第VIA族、Mg元素位于第三周期第IIA族、Al元素位于第三周期第IIIA族、S元素位于第三周期第VIA族、Cl元素位于第三周期第VIIA族,所以其在周期表中的位置为 ,
,
故答案为: ;
;
(2)铝原子核外有3个电子层、最外层有3个电子,其原子结构示意图为: ,
,
故答案为: ;
;
(3)电子层数越多,原子半径越大,电子层数相同时,原子序数越大,半径越小,则原子半径从大到小关系为:Mg>Al>S>Cl>O;
故答案为:Mg>Al>S>Cl>O;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,除了O元素为,非金属性最强的元素是Cl元素,则酸性最强的酸是HClO4,故答案为:HClO4;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁,则镁、氯形成的化合物中含有离子键,故答案为:离子.
 ,
,故答案为:
 ;
;(2)铝原子核外有3个电子层、最外层有3个电子,其原子结构示意图为:
 ,
,故答案为:
 ;
;(3)电子层数越多,原子半径越大,电子层数相同时,原子序数越大,半径越小,则原子半径从大到小关系为:Mg>Al>S>Cl>O;
故答案为:Mg>Al>S>Cl>O;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,除了O元素为,非金属性最强的元素是Cl元素,则酸性最强的酸是HClO4,故答案为:HClO4;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁,则镁、氯形成的化合物中含有离子键,故答案为:离子.
点评:本题考查元素周期表和元素周期律的综合应用,涉及元素周期律知识、原子结构示意图、元素在周期表中的位置确定等知识点,熟悉元素周期表结构、原子结构即可解答,注意把握原子半径大小的比较方法.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
某同学在做中和热的测定实验时,有些操作不规范,造成测得中和热的数值偏高,请你分析可能的原因( )
| A、测量盐酸的温度后,温度计没有用水冲洗干净 |
| B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C、量取盐酸时仰视读数 |
| D、将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL0.55 mol/L的氨水 |
对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
| ||
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
| ||
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,不一定有NH
| ||
| D、向待测液中加入KSCN溶液无现象,加入氯水后变为血红色,则待测液中含有Fe2+ |
 某环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
某环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
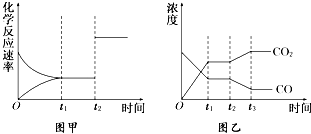 已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;