题目内容
2.将饱和FeCl3溶液滴入沸水中,继续煮沸,液体变为红褐色色,得到的分散系为Fe(OH)3胶体,用此分散系进行下列实验:(1)让光束通过该分散系,现象为胶体内出现一条光亮的“通路”,原因是胶体粒子对光的散射.
(2)向该分散系中逐滴滴入过量盐酸,会出现一系列变化:
①先出现红褐色沉淀,原因是HCl电离出来的离子(Cl-)所带的电荷与胶体粒子所带的电荷发生了电性中和,破坏了胶体的介稳性,从而使胶粒聚集成较大的颗粒沉降下来;
②随后沉淀逐渐溶解,溶液呈棕黄色,反应的化学方程式为Fe(OH)3+3HCl═FeCl3+3H2O.
分析 实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热;
(1)胶体粒子对光散射,用光垂直照射胶体都会产生丁达尔效应,即胶体内出现一条光亮的“通路”;
(2)①胶体能够发生聚沉以及酸能和Fe(OH)3 胶体反应;
②Fe(OH)3沉淀与盐酸反应生成棕黄色的Fe3+.
解答 解:向沸水中滴加 FeCl3溶液,继续煮沸可以制得红褐色氢氧化铁胶体,故答案为:红褐;Fe(OH)3胶体;
(1)用光垂直照射胶体都会产生丁达尔效应,即胶体内出现一条光亮的“通路”,这是因为胶体粒子对光的散射作用,故答案为:胶体内出现一条光亮的“通路”;胶体粒子对光的散射;
(2)①电解质溶液加入胶体会因破坏了胶体粒子的电荷稳定性,使其发生聚沉,成为Fe(OH)3沉淀,
故答案为:HCl电离出来的离子(Cl-)所带的电荷与胶体粒子所带的电荷发生了电性中和,破坏了胶体的介稳性,从而使胶粒聚集成较大的颗粒沉降下来;
②Fe(OH)3沉淀与盐酸反应生成棕黄色的Fe3+,Fe(OH)3+3HC1═FeCI3+3H2O,故答案为:Fe(OH)3+3HCl═FeCl3+3H2O.
点评 本题考查的是胶体的性质,难度不大,胶体的性质有:丁达尔效应、电泳、聚沉;利用丁达尔效应是区分胶体与溶液的一种常用物理方法.

练习册系列答案
相关题目
12.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
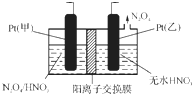 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.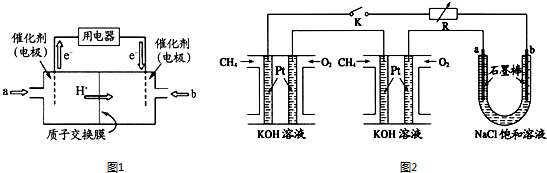
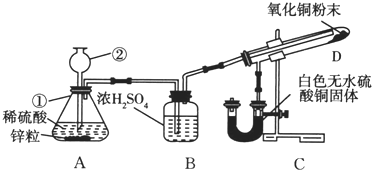 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
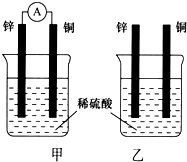 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题:
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题: