题目内容
7.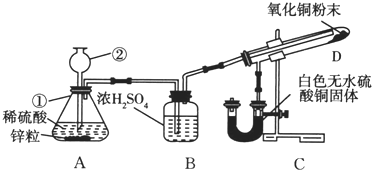 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.(1)写出编号仪器的名称:①锥形瓶;②长颈漏斗.
(2)浓H2SO4的作用是除去H2中的水蒸气(或干燥H2).
(3)本实验需要加热的装置为D(填字母编号).
(4)装置C、D中的现象分别为无水CuSO4固体变蓝、黑色CuO逐渐变红.
(5)在A、C、D三个装置发生的反应中属于氧化还原反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
分析 氢气还原氧化铜的实验:A装置为制取氢气的装置,实验室制取氢气常采用锌和稀硫酸来制取氢气,锌和稀硫酸在常温下反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑.D装置为氢气还原氧化铜的场所,氢气还原氧化铜时,氢气与氧化铜在加热条件下反应生成铜和水,该反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,氧化铜被还原,现象为黑色CuO逐渐变红,反应过程中生成的水流入装置C中,发生反应:CuSO4+5H2O═CuSO4•5H2O,无水硫酸铜变蓝,为防止H2中混有的水蒸气进入装置D,影响实验结果,应用浓硫酸对H2进行干燥.
(1)根据常见化学仪器名称结合装置图分析;
(2)为防止H2中混有的水蒸气进入装置D,影响实验结果,应用浓硫酸对H2进行干燥;
(3)根据反应的条件进行分析;
(4)装置C为白色硫酸铜粉末和水的反应,装置D为氢气还原氧化铜的反应,根据反应物、生成物的颜色分析现象;
(5)存在化合价的变化的反应为氧化还原反应,锌与稀硫酸的反应、氢气与氧化铜的反应中均存在化合价的变化.
解答 解:(1)根据熟悉常见化学仪器可知名称.图中①锥形瓶②长颈漏斗,
故答案为:锥形瓶;长颈漏斗;
(2)D装置为氢气还原氧化铜的场所,该反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,氧化铜被还原,现象为黑色CuO逐渐变红,反应过程中生成的水流入装置C中,发生反应:CuSO4+5H2O═CuSO4•5H2O,无水硫酸铜变蓝,为防止H2中混有的水蒸气进入装置D,影响实验结果,应用浓硫酸对H2进行干燥,浓硫酸具有吸水性,可以用于干燥氢气,
故答案为:除去H2中的水蒸气(或干燥H2);
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,
故答案为:D;
(4)装置C为白色硫酸铜粉末和水的反应,发生反应:CuSO4+5H2O═CuSO4•5H2O,CuSO4•5H2O为蓝色,现象为:无水CuSO4固体变蓝,装置D为氢气还原氧化铜的反应,该反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,氧化铜为黑色,铜为红色,现象为黑色CuO逐渐变红,
故答案为:无水CuSO4固体变蓝;黑色CuO逐渐变红;
(5)锌与稀硫酸的反应、氢气与氧化铜的反应中均存在化合价的变化,属于氧化还原反应,锌与稀硫酸的反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑,氢气与氧化铜在加热条进行反应生成铜和水,其反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
故答案为:Zn+H2SO4=ZnSO4+H2↑;H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
点评 本题考查了氢气的制备和性质实验,注意化学反应中物质颜色的变化,学习中要注重化学实验基本操作方法,侧重分析能力与实验能力的综合考查,题目难度中等.

 智慧小复习系列答案
智慧小复习系列答案| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
| A. | pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO -)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸浓溶液加少量水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$几乎不变 | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
| A. | 原子半径:E>B>C>D | |
| B. | A分别与B、C、D、E形成的简单化合物中,稳定性最好的和沸点最高的都是AD | |
| C. | E单质性质稳定,但其元素在自然界只能以化合态形式存在 | |
| D. | 化合物乙中一定含有共价键,可能含有离子键 |
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br- |
| A. | 酒精 | B. | H2 | C. | Na2SO4 | D. | SO2 |
| A. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| B. | 光导纤维遇强碱会“断路” | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
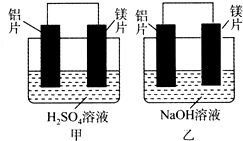 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol•L-1的H2SO4溶液中,乙同学将电极放入6 mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol•L-1的H2SO4溶液中,乙同学将电极放入6 mol•L-1的NaOH溶液中,如图所示.