题目内容
6.如表标出的是元素周期表的一部分元素,回答下列问题:| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
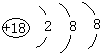 .
.(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为
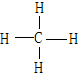 ;它的空间构型是正四面体.
;它的空间构型是正四面体.(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
分析 由元素在周期表中位置,可知A为氢、B为碳、C为Na、D为Mg、E为Al、F为磷、G为硫、H为Cl、I为Ar、J为Fe、K为Br.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;
(2)氢氧化铝是两性氢氧化物,C最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;非金属性越强,对应氢化物越稳定;
(4)A和B可形成最简单的有机化合物为CH4;
(5)非金属性越强,对应单质氧化性越强;
(6)氧化铁与CO反应生成Fe与二氧化碳.
解答 解:由元素在周期表中位置,可知A为氢、B为碳、C为Na、D为Mg、E为Al、F为磷、G为硫、H为Cl、I为Ar、J为Fe、K为Br.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,原子核外电子数为18,原子结构示意图为: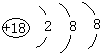 ,
,
故答案为:Ar;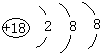 ;
;
(2)Al元素的氢氧化物--氢氧化铝是两性氢氧化物,C最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)金属性Na>Mg>Al,故最高价氧化物对应水化物中NaOH的碱性最强;非金属性越强P<S<Cl,氢化物越稳定与元素非金属性一致,故HCl最稳定,
故答案为:NaOH;HCl;
(4)A和B可形成最简单的有机化合物为CH4,结构式为 ,为正四面体结构,
,为正四面体结构,
故答案为: ;正四面体;
;正四面体;
(5)非金属性Cl>Br,非金属性越强,对应单质氧化性越强,故氧化性:Cl2>Br2,
故答案为:Br2;
(6)氧化铁与CO反应生成Fe与二氧化碳,反应方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 本题考查元素周期表与元素周期律,熟练掌握元素周期表的结构,(6)中方程式书写为易错点,必修中不涉及工业高炉炼铁.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为4NA | |
| C. | 常温常压下,15g乙烷分子中含有的碳氢键数目为3 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②霸王洗发液不含任何化学物质
③夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉的原因
④53度白酒是指该白酒的着火点是53℃
⑤太太口服液含丰富的氮、磷、锌等微量元素.
则有关上述说法,你的看法是( )
| A. | 全部正确 | B. | 只有①⑤正确 | ||
| C. | 只有③正确 | D. | 以上说法都是错误的 |
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| A. | CH≡CH | B. | CH2=CH2 | C. | CH2=C(CH3)CH3 | D. | CH≡C-CH3 |

 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.