题目内容
18.已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1)如果A、B、C、D均是10电子的粒子,请写出A、D的化学式:ANH4+ DH2O.
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式为:HS-+OH-═S2-+H2O.
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)OH->S2-..
分析 (1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+,B为OH-,C为NH3,D为H2O;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S(或HS-),B为OH-,C为HS-或S2-,D为H2O.
解答 解:(1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+,B为OH-,C为NH3,D为H2O,
故答案为:NH4+;H2O;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S(或HS-),B为OH-,C为HS-或S2-,D为H2O,A与B在溶液中反应的离子方程式为:HS-+OH-═S2-+H2O等,根据离子方程式,可以判断结合质子的能力大小是OH->S2-,
故答案为:HS-+OH-═S2-+H2O;OH->S2-.
点评 本题考查无机物推断,熟练掌握常见10电子、18电子微粒的结构和性质应用,难度中等.

练习册系列答案
相关题目
8.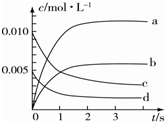 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(4)图中表示NO2的变化的曲线是b. 用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(4)图中表示NO2的变化的曲线是b. 用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
9.下列各组物质中,所含分子数相同的是( )
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和11.2L O2 | D. | 224mL H2(标准状况下)和0.1mol N2 |
6.如表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),其原子结构示意图为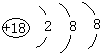 .
.
(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为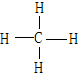 ;它的空间构型是正四面体.
;它的空间构型是正四面体.
(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
 .
.(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为
 ;它的空间构型是正四面体.
;它的空间构型是正四面体.(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体中含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
10.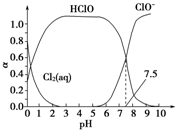 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
| A. | 由图象可知:Ka=10-7.5 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)>c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,杀菌效果最佳pH范围为3~6 | |
| D. | 往氯气-氯水体系中加少量碳酸钙,可提高体系漂白性 |
7.下列有机反应属于加成反应的是( )
| A. | (CH3)2C=O+HCN→(CH3)2C(OH)CN | B. | CH3CH2OH→CH2=CH2↑+H2O | ||
| C. | 2CH3CHO+O2→2CH3COOH | D. | CHCl3+HF→CHFCl2+HCl |
10. Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
 Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )| A. | 电池工作时,K+向负极移动 | |
| B. | 电池工作时,Al电极周围溶液pH增大 | |
| C. | 电池工作时,电子由Al经溶液流向Ni | |
| D. | 正极反应为MnO4-+2H2O+3e-═MnO2+4OH- |
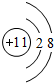 .
.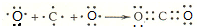 .
.