题目内容
11.下列表示对应化学反应的离子方程式正确的是( )| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
分析 A.酸性溶液中不能生成氢氧根离子;
B.醋酸在离子反应中保留化学式;
C.物质的量比为1:2,反应生成硫酸钡、氢氧化铝、一水合氨;
D.碳酸氢钠完全反应,生成碳酸钙、NaOH和水.
解答 解:A.用KIO3氧化酸性溶液中的KI的离子反应为5I-+IO3-+6H+═3I2+3H2O,故A错误;
B.硅酸钠溶液与醋酸溶液混合的离子反应为SiO32-+2CH3COOH═2CH3COO-+H2SiO3↓,故B错误;
C.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合发生NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O,故C正确;
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀为HCO3-+Ca2++OH-═CaCO3↓+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
19.下列说法正确的是( )
| A. | N-H键键能的含义是把1molNH3中的共价键全部拆开所吸收的能量 | |
| B. | ClO-的空间构型为平面三角形 | |
| C. | 卤素单质从F2到I2,在常温常压下的聚集状态由气态、液态到固态的原因是原子半径逐渐增大 | |
| D. | 熔点由高到低的顺序为:金刚石>MgO>NaCl>CCl4 |
6.如表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),其原子结构示意图为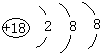 .
.
(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为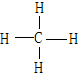 ;它的空间构型是正四面体.
;它的空间构型是正四面体.
(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
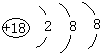 .
.(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为
 ;它的空间构型是正四面体.
;它的空间构型是正四面体.(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
16.元素单质及其化合物有广泛用途,对于元素周期表中第3周期的元素来说,按原子序数递增的顺序(稀有气体除外),以下说法正确的是( )
| A. | 原子半径和离子半径均减小 | |
| B. | 金属性减弱,非金属性增强 | |
| C. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| D. | 单质的熔点降低 |
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体中含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
 .
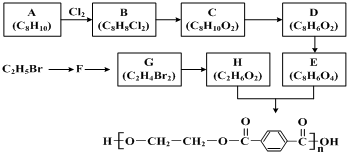
.
 ;
; (写出结构简式).
(写出结构简式).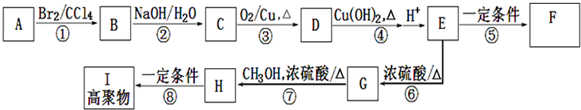
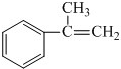 ;E在一定条件下能形成3个六元环的物质,该物质的结构简式为:
;E在一定条件下能形成3个六元环的物质,该物质的结构简式为: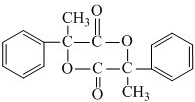 .
.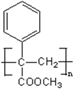 .
.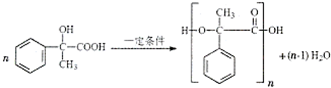 .
.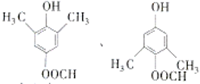 .
.