题目内容
15. 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.①为获得尽可能纯的NaH2PO4,pH应控制在4~5.5(介于此区间内的任意值或区间均可).
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
分析 (1)根据为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;
(2)若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性.
解答 解:(1)为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可),
故答案为:4~5.5(介于此区间内的任意值或区间均可);
(2)HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;
由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性,
故答案为:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+.
点评 本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握图象所给信息,为解答该题的关键,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
6.如表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),其原子结构示意图为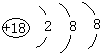 .
.
(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为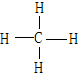 ;它的空间构型是正四面体.
;它的空间构型是正四面体.
(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
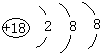 .
.(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为
 ;它的空间构型是正四面体.
;它的空间构型是正四面体.(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体中含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
10.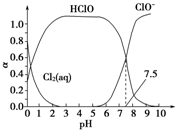 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
| A. | 由图象可知:Ka=10-7.5 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)>c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,杀菌效果最佳pH范围为3~6 | |
| D. | 往氯气-氯水体系中加少量碳酸钙,可提高体系漂白性 |
7.下列有机反应属于加成反应的是( )
| A. | (CH3)2C=O+HCN→(CH3)2C(OH)CN | B. | CH3CH2OH→CH2=CH2↑+H2O | ||
| C. | 2CH3CHO+O2→2CH3COOH | D. | CHCl3+HF→CHFCl2+HCl |
7.用FeCl3溶液无法区别的一组试剂是( )
| A. | KSCN溶液、KCl溶液 | B. | NaOH溶液、NaCl溶液 | ||
| C. | 稀盐酸、稀硝酸 | D. | AgNO3溶液、稀HNO3 |
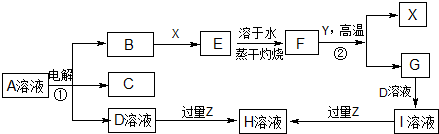
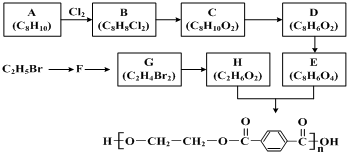
 ;
; (写出结构简式).
(写出结构简式). ③
③ ⑤
⑤ .
.