题目内容
17.把54g Al放入足量盐酸(HCl)中完全反应,计算生成H2的体积(标准状况).分析 Al与盐酸反应的化学方程式为:2Al+6HCl=2ACl3+3H2↑,先根据n=$\frac{m}{M}$计算出54g铝的物质的量,然后根据方程式计算出生成氢气的物质的量,最后根据V=nVm计算出生成氢气体积.
解答 解:铝与盐酸发生反应为:2Al+6HCl=2ACl3+3H2↑,
54gAl的物质的量为:$\frac{54g}{27g/mol}$=2mol,根据反应可知,2molAl完全反应生成3mol氢气,
标准状况下3mol氢气的体积为:22.4L/mol×3mol=67.2L,
答:54gAl与足量盐酸反应生成氢气在标准状况下的体积为67.2L.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法中正确的是( )
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
8.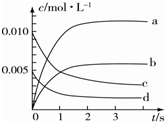 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(4)图中表示NO2的变化的曲线是b. 用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(4)图中表示NO2的变化的曲线是b. 用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
9.下列各组物质中,所含分子数相同的是( )
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和11.2L O2 | D. | 224mL H2(标准状况下)和0.1mol N2 |
6.如表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),其原子结构示意图为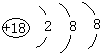 .
.
(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为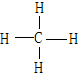 ;它的空间构型是正四面体.
;它的空间构型是正四面体.
(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
 .
.(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)在C、D、E形成的氢氧化物中,碱性最强的是NaOH(用化学式表示);在F、G、H形成的氢化物中最稳定的是HCl(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为
 ;它的空间构型是正四面体.
;它的空间构型是正四面体.(5)在H、K对应的单质中,氧化性较弱的是Br2(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
7.下列有机反应属于加成反应的是( )
| A. | (CH3)2C=O+HCN→(CH3)2C(OH)CN | B. | CH3CH2OH→CH2=CH2↑+H2O | ||
| C. | 2CH3CHO+O2→2CH3COOH | D. | CHCl3+HF→CHFCl2+HCl |

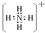 .
.