题目内容
A、B、C分别是由H、C、O、N、Na、Cu等六种元素中的两种或多种元素组成的化合物.现对A、B、C,D三种化合物分别做以下实验:A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体.分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性.
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生.将56.8g A隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水.生成的Y折合成标准状况下的体积为6.72L.则A的化学式为 .
(2)取B的水溶液2mL与新制Cu(OH)2混合加热,发现能出现砖红色沉淀. 则物质B为 .
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g.
写出C物质加入水后的或电离方程式或离子方程式并说明水溶液显碱性的原因 .
(4)D 是一种含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成分的相对分子质量相同,则该物质的结构简式为: ;D为一种二元弱碱,则D与过量硫酸反应的产物是 (用化学式表示),D与一种黑色氧化物反应的产物中有一种气态单质及(2)中出现的砖红色物质.写出其化学方程式: .
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生.将56.8g A隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水.生成的Y折合成标准状况下的体积为6.72L.则A的化学式为
(2)取B的水溶液2mL与新制Cu(OH)2混合加热,发现能出现砖红色沉淀. 则物质B为
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g.
写出C物质加入水后的或电离方程式或离子方程式并说明水溶液显碱性的原因
(4)D 是一种含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成分的相对分子质量相同,则该物质的结构简式为:
考点:复杂化学式的确定,化学方程式的有关计算
专题:计算题
分析:(1)A为不溶于水的蓝色固体,可能含有铜离子,再根据隔绝空气加热A生成黑色固体,黑色固体应该为氧化铜,根据标况下的密度可以计算出无色气体Y的摩尔质量,从而判断Y为二氧化碳,则A中一定含有碳酸根离子;再根据生成水的质量及碱式碳酸铜的组成判断A的化学式;
(2)根据B溶于水,溶液显示碱性,能够与新制氢氧化铜反应判断B为甲酸盐,再根据题干提供的元素名称判断B的名称;
(3)根据C加热生成二氧化碳和水判断C为碳酸氢盐,根据C为无色固体可知C为碳酸氢钠,由于碳酸根离子的水解程度大于其电离程度,则碳酸氢钠溶液显示碱性;
(4)D是含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如为氮气,则相对分子质量为28,没有符合物质,如为氧气,则相对分子质量为32,通过计算得出D的分子式为N2H4;类比氨气与硫酸的反应判断反应产物;根据题干信息找出反应物、生成物,然后根据化合价变化相等配平反应的化学方程式.
(2)根据B溶于水,溶液显示碱性,能够与新制氢氧化铜反应判断B为甲酸盐,再根据题干提供的元素名称判断B的名称;
(3)根据C加热生成二氧化碳和水判断C为碳酸氢盐,根据C为无色固体可知C为碳酸氢钠,由于碳酸根离子的水解程度大于其电离程度,则碳酸氢钠溶液显示碱性;
(4)D是含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如为氮气,则相对分子质量为28,没有符合物质,如为氧气,则相对分子质量为32,通过计算得出D的分子式为N2H4;类比氨气与硫酸的反应判断反应产物;根据题干信息找出反应物、生成物,然后根据化合价变化相等配平反应的化学方程式.
解答:
解:(1)标准状况下,Y气体的密度为1.96g/L,Y的摩尔质量为:22.4L/mol×1.96g/L≈44g/mol,无色气体为二氧化碳,40g黑色固体为CuO,物质的量为:
=0.5mol,标况下6.72L二氧化碳的物质的量为:
=0.3mol,0.3mol二氧化碳的质量为:44g/mol×0.3mol=13.2g,56.8g A分解生成水的质量为:56.8g-40g-13.2g=3.6g,水的物质的量为:
=0.2mol,A为蓝色不溶于水的固体,联系碱式碳酸铜的组成可知,固体A中应该含有碳酸根离子、铜离子和氢氧根离子,根据原子守恒,n(Cu2+):n(OH):n(CO32-)=0.5mol:0.2mol×2:0.3mol=5:4:3,则A的化学式为:Cu5(OH)4(CO3)3,
故答案为:Cu5(OH)4(CO3)3 ;
(2)B是能够溶于水的晶体,B的溶液显示碱性,B与新制Cu(OH)2混合加热,能出现砖红色沉淀,B分子中一定含有醛基-CHO,B只能为甲酸盐,且式量为68,根据题干提供的元素,满足条件的只能为甲酸钠,
故答案为:HCOONa;
(3)氯化钙固体增重的为水的质量,氢氧化钡增重的4.4g为二氧化碳的质量,说明B加热分解生成二氧化碳和水,说明C为碳酸氢盐,再根据C为无色固体,水溶液显示碱性,则C只能为碳酸氢钠,碳酸氢钠电离方程式为:HCO3-=H++CO32-;其水解方程式为:HCO3-+H2O=H2CO3+OH-,由于碳酸氢根离子的水解程度反应其电离程度,则碳酸氢钠溶液显示碱性,
故答案为:HCO3-=H++CO32-;HCO3-+H2O=H2CO3+OH-;HCO3-水解程度大于电离程度;
(4)D为含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如果为氮气,氮气的相对分子质量为28,含有氮原子的总原子量为:28×87.5%=24.5,则没有符合物质,若为氧气,则氧气相对分子质量为32,则该化合物含N的总原子量为:32×87.5%=28,则D中含有2个N原子,另外只能含有H原子,数目为4,所以D的分子式为N2H4,其结构简式为:NH2-NH2;
N2H4与硫酸反应的方程式为:N2H4+H2SO4=N2H6SO4,则产物为N2H6SO4;
在(2)中生成的砖红色物质为Cu2O,则黑色氧化物为CuO,反应为N2H4和CuO,反应产物为N2、Cu2O、和水,根据化合价变化配平反应的化学方程式为:N2H4+4CuO=2Cu2O+N2↑+2H2O,
故答案为:NH2-NH2;N2H6SO4;N2H4+4CuO=2Cu2O+N2↑+2H2O.
| 40g |
| 80g/mol |
| 6.72L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
故答案为:Cu5(OH)4(CO3)3 ;
(2)B是能够溶于水的晶体,B的溶液显示碱性,B与新制Cu(OH)2混合加热,能出现砖红色沉淀,B分子中一定含有醛基-CHO,B只能为甲酸盐,且式量为68,根据题干提供的元素,满足条件的只能为甲酸钠,
故答案为:HCOONa;
(3)氯化钙固体增重的为水的质量,氢氧化钡增重的4.4g为二氧化碳的质量,说明B加热分解生成二氧化碳和水,说明C为碳酸氢盐,再根据C为无色固体,水溶液显示碱性,则C只能为碳酸氢钠,碳酸氢钠电离方程式为:HCO3-=H++CO32-;其水解方程式为:HCO3-+H2O=H2CO3+OH-,由于碳酸氢根离子的水解程度反应其电离程度,则碳酸氢钠溶液显示碱性,
故答案为:HCO3-=H++CO32-;HCO3-+H2O=H2CO3+OH-;HCO3-水解程度大于电离程度;
(4)D为含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如果为氮气,氮气的相对分子质量为28,含有氮原子的总原子量为:28×87.5%=24.5,则没有符合物质,若为氧气,则氧气相对分子质量为32,则该化合物含N的总原子量为:32×87.5%=28,则D中含有2个N原子,另外只能含有H原子,数目为4,所以D的分子式为N2H4,其结构简式为:NH2-NH2;
N2H4与硫酸反应的方程式为:N2H4+H2SO4=N2H6SO4,则产物为N2H6SO4;
在(2)中生成的砖红色物质为Cu2O,则黑色氧化物为CuO,反应为N2H4和CuO,反应产物为N2、Cu2O、和水,根据化合价变化配平反应的化学方程式为:N2H4+4CuO=2Cu2O+N2↑+2H2O,
故答案为:NH2-NH2;N2H6SO4;N2H4+4CuO=2Cu2O+N2↑+2H2O.
点评:本题考查了化学方程式的计算、无机推断,题目难度较大,涉及的知识点较多,注意掌握无机推断的方法与技巧,明确有关化学方程式的书写、计算方法,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
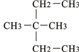 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥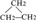 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?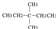 ?CH≡CH?
?CH≡CH?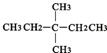 ?H2
?H2 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: