题目内容
在密闭容器中,合成氨的反应N2(g)+3H2(g)?2NH3(g),开始时N2的浓度为8mol/L,H2的浓度为20mol/L,5min后N2的浓度6mol/L,求这段时间中:
(1)N2的平均反应速率.
(2)H2的平均反应速率.
(3)NH3的平均反应速率.
(1)N2的平均反应速率.
(2)H2的平均反应速率.
(3)NH3的平均反应速率.
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据化学反应速率的定义和化学反应速率之比等化学计量数之比进行计算.
解答:
解:(1)v(N2)=
=
=0.4mol/(L?min);
答:N2的平均反应速率为0.4mol/(L?min);
(2)v(N2):v(H2)=1:3,故v(H2)=0.4×3=1.2mol/(L?min);
答:H2的平均反应速率为1.2mol/(L?min);
(3)v(N2):v(NH3)=1:2,故v(NH3)=0.4×2=0.8mol/(L?min);
答:NH3的平均反应速率为0.8mol/(L?min).
| △c |
| △t |
| 8-6 |
| 5 |
答:N2的平均反应速率为0.4mol/(L?min);
(2)v(N2):v(H2)=1:3,故v(H2)=0.4×3=1.2mol/(L?min);
答:H2的平均反应速率为1.2mol/(L?min);
(3)v(N2):v(NH3)=1:2,故v(NH3)=0.4×2=0.8mol/(L?min);
答:NH3的平均反应速率为0.8mol/(L?min).
点评:本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.

练习册系列答案
相关题目
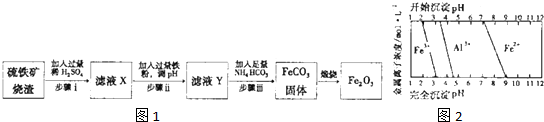
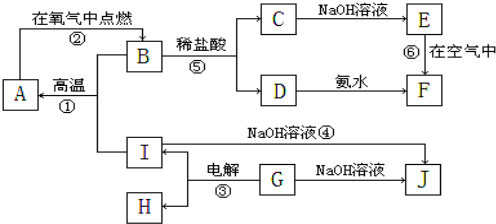
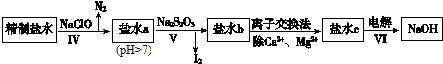
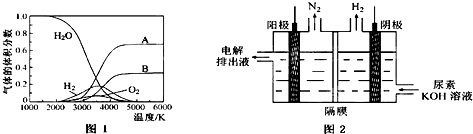
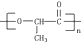 由一种单体缩聚而成的,该单体的结构简式为
由一种单体缩聚而成的,该单体的结构简式为