题目内容
现有下列15种物质和基团,根据要求填空.
①液氯 ②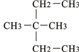 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
Cl ⑦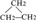 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?
Cl?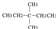 ?CH≡CH?
?CH≡CH?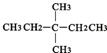 ?H2
?H2
(1)按系统命名法命? ,其可由单稀烃 (写名称)加氢得到.1mol?可与 mol⑧在光照条件下充分反应产生全氯代烷.
(2)上述 (填编号)物质在一定条件下可制得聚氯乙烯.请写出相关的化学反应方程式 .
(3)写出实验室以⑨为原料制备乙醚的化学反应方程式 .
(4)上述物质中互为同系物的 ,互为同分异构体的 ,互为同位素的 ,互为同素异形体的 ,属于同种物质的 .
①液氯 ②
 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥37 17 |
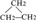 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?35 17 |
 ?CH≡CH?
?CH≡CH? ?H2
?H2(1)按系统命名法命?
(2)上述
(3)写出实验室以⑨为原料制备乙醚的化学反应方程式
(4)上述物质中互为同系物的
考点:有机化合物命名,同位素及其应用,同素异形体,有机物分子中的官能团及其结构,有机化合物的异构现象,芳香烃、烃基和同系物
专题:有机化学基础
分析:(1)根据烷烃的命名方法对有机物物进行命名,烯烃可以和氢气之间发生加成反应得到烷烃,烃分子中含有多少氢原子那就需要多少氯气来和它发生取代反应;
(2)聚氯乙烯是氯乙烯的加聚产物,氯乙烯可以由乙炔和氯化氢加成得到,氯化氢可以由氢气和氯气化和得到,据此回答;
(3)乙醇分子间脱水可以获得乙醚;
(4)根据同系物、同分异构体、同位素、同素异形体、同种物质的概念来回答.
(2)聚氯乙烯是氯乙烯的加聚产物,氯乙烯可以由乙炔和氯化氢加成得到,氯化氢可以由氢气和氯气化和得到,据此回答;
(3)乙醇分子间脱水可以获得乙醚;
(4)根据同系物、同分异构体、同位素、同素异形体、同种物质的概念来回答.
解答:
解:1)根据烷烃的命名方法,该有机物的名称是:3,3-二甲基戊烷,烯烃3,3-二甲基-1-戊烯可以和氢气之间发生加成反应得到烷烃3,3-二甲基戊烷,1mol 中含有16mol氢原子,所以需要16mol氯气来和它发生取代反应产生全氯代烷,故答案为:3,3-二甲基戊烷;3,3-二甲基-1-戊烯;16;
中含有16mol氢原子,所以需要16mol氯气来和它发生取代反应产生全氯代烷,故答案为:3,3-二甲基戊烷;3,3-二甲基-1-戊烯;16;
(2)采用逆推法:聚氯乙烯是氯乙烯的加聚产物,氯乙烯可以由乙炔和氯化氢加成得到,氯化氢可以由氢气和氯气化和得到,用氢气、氯气、乙炔为原料制取聚氯乙烯发生的反应为:H2+Cl2
2HCl,CH≡CH+HCl
CH2═CHCl,nCH2═CHCl
 ,
,
故答案为:⑧??或①??;H2+Cl2
2HCl,CH≡CH+HCl
CH2═CHCl,nCH2═CHCl
 ;
;
(3)乙醇分子间脱水可以获得乙醚,即2CH3CH2OH
CH3CH2OCH2CH3+H2O,故答案为:即2CH3CH2OH
CH3CH2OCH2CH3+H2O;
(4)⑨?是结构相似、分子组成上相差整数倍个-CH2-结构的有机物,属于同系物;③⑦分子式相同,但是结构不同,互为同分异构体;⑥?是质子数相等,中子数不相等的同种元素的不同原子,互为同位素;④⑩是同元素的不同单质,互为同素异形体、①⑧或②?是同种物质,故答案为:⑨?;③⑦;⑥?;④⑩;①⑧或②?.
 中含有16mol氢原子,所以需要16mol氯气来和它发生取代反应产生全氯代烷,故答案为:3,3-二甲基戊烷;3,3-二甲基-1-戊烯;16;
中含有16mol氢原子,所以需要16mol氯气来和它发生取代反应产生全氯代烷,故答案为:3,3-二甲基戊烷;3,3-二甲基-1-戊烯;16;(2)采用逆推法:聚氯乙烯是氯乙烯的加聚产物,氯乙烯可以由乙炔和氯化氢加成得到,氯化氢可以由氢气和氯气化和得到,用氢气、氯气、乙炔为原料制取聚氯乙烯发生的反应为:H2+Cl2
| ||
| 一定条件 |
| 一定条件 |
 ,
,故答案为:⑧??或①??;H2+Cl2
| ||
| 一定条件 |
| 一定条件 |
 ;
;(3)乙醇分子间脱水可以获得乙醚,即2CH3CH2OH
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| 140℃ |
(4)⑨?是结构相似、分子组成上相差整数倍个-CH2-结构的有机物,属于同系物;③⑦分子式相同,但是结构不同,互为同分异构体;⑥?是质子数相等,中子数不相等的同种元素的不同原子,互为同位素;④⑩是同元素的不同单质,互为同素异形体、①⑧或②?是同种物质,故答案为:⑨?;③⑦;⑥?;④⑩;①⑧或②?.
点评:本题涉及有机物的命名、物质的制备、有机物的性质以及“五同”概念的理解等知识和,综合性强,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、1H和3H的质子数相同,它们是同种核素 |
| B、6Li和7Li的质子数相等,电子数也相等 |
| C、14C和14N的质量数相等,它们的中子数相等 |
| D、13C和14C属于同一种元素,它们的质量数相等 |
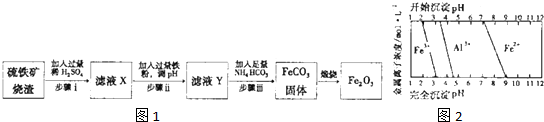
 铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.
铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.
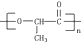 由一种单体缩聚而成的,该单体的结构简式为
由一种单体缩聚而成的,该单体的结构简式为