题目内容
单质、氧化物、酸、碱及盐之间的转化是元素及其化合物的主要研究内容,试按要求完成下列试题:
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷(P4),反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+2P2O5 10C+2P2O5=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有 .
(2)试写出实验室制取CO2气体的离子方程式: ;
(3)实验室常使用浓盐酸与MnO2固体共热制取Cl2,当制得0.1mol Cl2时,被氧化的HCl的物质的量为 mol.
(4)将1molC与5molO2充分反应后的气体,全部通入到足量Na2O2再充分反应后,剩余气体的物质的量为 mol.
(5)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是 .
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷(P4),反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+2P2O5 10C+2P2O5=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有
(2)试写出实验室制取CO2气体的离子方程式:
(3)实验室常使用浓盐酸与MnO2固体共热制取Cl2,当制得0.1mol Cl2时,被氧化的HCl的物质的量为
(4)将1molC与5molO2充分反应后的气体,全部通入到足量Na2O2再充分反应后,剩余气体的物质的量为
(5)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是
考点:氧化还原反应的计算,酸、碱、盐、氧化物的概念及其相互联系
专题:
分析:(1)与碱反应生成盐和水的氧化物,为酸性氧化物;
(2)实验室用石灰石和稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,水、二氧化碳、碳酸钙在离子反应中保留化学式;
(3)结合HCl为还原剂,对应氧化产物为氯气及原子守恒分析;
(4)发生反应C+O2
CO2,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,故充分反应后,容器内剩余气体为二氧化碳反应生成的氧气及原来剩余的氧气;
(5)双氧水具有氧化性,能将还原性的离子碘离子、亚铁离子氧化.
(2)实验室用石灰石和稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,水、二氧化碳、碳酸钙在离子反应中保留化学式;
(3)结合HCl为还原剂,对应氧化产物为氯气及原子守恒分析;
(4)发生反应C+O2
| ||
(5)双氧水具有氧化性,能将还原性的离子碘离子、亚铁离子氧化.
解答:
解:(1)三种氧化物中CO为不成盐氧化物,只有SiO2、P2O5为酸性氧化物,故答案为:SiO2、P2O5;
(2)实验室用石灰石和稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,水、二氧化碳、碳酸钙在离子反应中保留化学式,离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故答案为:CaCO3+2H+═H2O+CO2↑+Ca2+;
(3)HCl为还原剂,对应氧化产物为氯气,由Cl原子守恒可知,制得0.1mol Cl2时,被氧化的HCl的物质的量为0.1mol×2=0.2mol,故答案为:0.2;
(4)由C+O2
CO2,1molC与5molO2充分反应后的气体后生成1molCO2,剩余4molO2,再由2CO2+2Na2O2=2Na2CO3+O2,二氧化碳完全反应生成0.5mol氧气,剩余气体的物质的量为4mol+0.5mol=4.5mol,故答案为:4.5;
(5)双氧水具有氧化性,能将还原性的离子碘离子、亚铁离子氧化,消耗2molI-时,共转移3mol电子,原理方程式为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2,
故答案为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2.
(2)实验室用石灰石和稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,水、二氧化碳、碳酸钙在离子反应中保留化学式,离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故答案为:CaCO3+2H+═H2O+CO2↑+Ca2+;
(3)HCl为还原剂,对应氧化产物为氯气,由Cl原子守恒可知,制得0.1mol Cl2时,被氧化的HCl的物质的量为0.1mol×2=0.2mol,故答案为:0.2;
(4)由C+O2
| ||
(5)双氧水具有氧化性,能将还原性的离子碘离子、亚铁离子氧化,消耗2molI-时,共转移3mol电子,原理方程式为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2,
故答案为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2.
点评:本题考查较综合,涉及物质分类、氧化还原反应的计算及离子反应方程式的书写等,为高频考点,把握相关概念及反应中元素的化合价变化、离子反应的书写方法等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
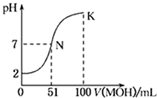 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、N点水的电离程度小于K点水的电离程度 |
| C、K点所示溶液中c(A-)>c(M+) |
| D、K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
下列仪器①蒸馏烧瓶②试管③蒸发皿④容量瓶⑤冷凝管⑥烧杯中能用酒精灯直接加热的是( )
| A、②③⑤ | B、②③ |
| C、①③④ | D、③⑤⑥ |
某温度下,H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
食物是维持人类生命和健康的支柱.下表是某食品包装袋上的说明:对上表中各种配料成分的理解不正确的是( )
| 品名 | 蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2008年11月6日 |
| A、富含蛋白质的是鲜鸡蛋 |
| B、富含维生素的是脱水青菜和橙汁 |
| C、富含淀粉的是面粉和白砂糖 |
| D、富含油脂的是精炼食用植物油和奶油 |
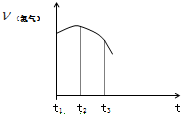 把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是