题目内容
(1)在3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O反应中, 是氧化剂; 是还原剂;被还原的HNO3与参加反应的HNO3物质的量之比是 ;若有1molCu被氧化,则被还原的硝酸质量为 g;若参加反应的硝酸为1.6mol,则放出气体的体积(在标准状况下)为 L.
将下面的反应用单线桥或双线桥法标出电子转移的方向和数目:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明.(提示:请写出实验步骤、现象及结论)
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
Ⅰ所需试剂编号
Ⅱ实验步骤、现象及结论 .
将下面的反应用单线桥或双线桥法标出电子转移的方向和数目:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明.(提示:请写出实验步骤、现象及结论)
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
Ⅰ所需试剂编号
Ⅱ实验步骤、现象及结论
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,以此来解答;
(2)选取含有Fe3+和I-的试剂,若能生成I2,则能使淀粉溶液变蓝.
(2)选取含有Fe3+和I-的试剂,若能生成I2,则能使淀粉溶液变蓝.
解答:
解:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,Cu为还原剂,N元素的化合价降低,HNO3为氧化剂,由反应可知8molHNO3反应只有2mol作氧化剂,被还原的HNO3与参加反应的HNO3物质的量之比是1:4,从反应中看出3molCu和8mol硝酸反应,有6mol硝酸被还原,质量m=
×2mol×63g/mol=42g,
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
8mol 44.8L
1.6mol V
V=
=8.96L,
反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中Cu失电子,硝酸得电子,用双线桥表示为 ,用单线桥表示为
,用单线桥表示为 ,
,
故答案为:HNO3;Cu;1:4;42;8.96; ;
; ;
;
(2)选取含有Fe3+和I-的试剂,若能生成I2,则能使淀粉溶液变蓝,所以选取①FeCl3溶液③KI溶液⑤淀粉溶液,取少量FeCl3溶液于洁净试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2.
故答案为:①③⑤;取少量FeCl3溶液于洁净试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2.
| 1 |
| 3 |
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
8mol 44.8L
1.6mol V
V=
| 44.8L×1.6mol |
| 8mol |
反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中Cu失电子,硝酸得电子,用双线桥表示为
 ,用单线桥表示为
,用单线桥表示为 ,
,故答案为:HNO3;Cu;1:4;42;8.96;
 ;
; ;
;(2)选取含有Fe3+和I-的试剂,若能生成I2,则能使淀粉溶液变蓝,所以选取①FeCl3溶液③KI溶液⑤淀粉溶液,取少量FeCl3溶液于洁净试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2.
故答案为:①③⑤;取少量FeCl3溶液于洁净试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
下列检验方法和结论都正确的是( )
| A、加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有大量Cl- |
| B、加入硝酸后的溶液中,滴加BaCl2溶液,有白色沉淀生成,证明原溶液中一定有大量SO42- |
| C、加入盐酸后,放出能使澄清石灰水变浑浊的无色气体,证明原溶液中一定含有大量CO32- |
| D、加入无色酚酞试液后,溶液显红色,证明原溶液中一定含有大量OH- |
对实验Ⅰ~Ⅳ的实验现象预测正确的是( )


| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C、实验Ⅲ:试管中溶液颜色仍无色 |
| D、实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.方案一:2.7g Al
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
已知:NaOH溶液和稀盐酸的浓度均是3mol?L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |
能用如图气体制取装置制取少量气体并能“随开随用、随关随停”的是( )
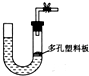

| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、过氧化钠和水制取氧气 |
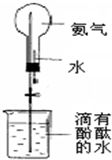 (1)写出实验室制取氨气的化学方程式:
(1)写出实验室制取氨气的化学方程式: