题目内容
实验室里迅速制备少量氯气可利用以下反应:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)上述反应的还原产物是 (填化学式),体现的盐酸的性质有 ,该反应的离子方程式是 ,
(2)①用“双线桥法”标明电子转移的方向和数目:
②用该浓盐酸制得了标况下560mLCl2,则被氧化的HCl为 mol,需要KMnO4的质量 g.
(1)上述反应的还原产物是
(2)①用“双线桥法”标明电子转移的方向和数目:
②用该浓盐酸制得了标况下560mLCl2,则被氧化的HCl为
考点:氧化还原反应的计算,离子方程式的书写,氧化还原反应的电子转移数目计算
专题:
分析:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价降低,在离子繁华中氯气、水保留化学式,结合氧化还原反应中元素的化合价计算来解答.
解答:
解:(1)Mn元素的化合价降低,得到电子被还原,则还原产物为MnCl2,HCl中Cl元素的化合价升高,为还原剂,且生成氯化锰,体现其酸性,该反应的离子反应为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+10H2O,
故答案为:MnCl2;酸性和还原性;2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+10H2O;
(2)①高锰酸钾和浓盐酸的反应中,Mn得到电子、Cl失去电子,转移电子的表示方法为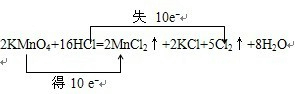 ,
,
故答案为: ;
;
②标况下560mLCl2,其物质的量为
=0.025mol,由Cl原子守恒可知被氧化的HCl为0.025mol×2=0.05 mol,需要KMnO4的质量为0.025mol×
×158g/mol=1.58g,故答案为:0.05;1.58.
故答案为:MnCl2;酸性和还原性;2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+10H2O;
(2)①高锰酸钾和浓盐酸的反应中,Mn得到电子、Cl失去电子,转移电子的表示方法为
 ,
,故答案为:
 ;
;②标况下560mLCl2,其物质的量为
| 0.56L |
| 22.4L/mol |
| 2 |
| 5 |
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
对实验Ⅰ~Ⅳ的实验现象预测正确的是( )
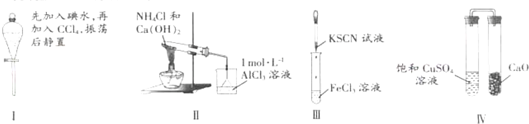

| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C、实验Ⅲ:试管中溶液颜色仍无色 |
| D、实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
某溶液中含有较大量的Cl-、OH-、CO32-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加过量Mg(NO3)2;
②滴加过量MgCl2;
③滴加过量AgNO3溶液;
④滴加过量Ba(NO3)2溶液;
⑤滴加过量BaCl2溶液;
⑥过滤.
①滴加过量Mg(NO3)2;
②滴加过量MgCl2;
③滴加过量AgNO3溶液;
④滴加过量Ba(NO3)2溶液;
⑤滴加过量BaCl2溶液;
⑥过滤.
| A、①⑥④⑥③ |
| B、②⑥⑤⑥③ |
| C、④⑥①⑥③ |
| D、⑤⑥②⑥③ |
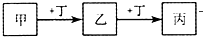 甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )| A、若甲是AlCl3溶液,则丁可能是NaOH溶液 |
| B、若甲是Cl2,则丁可能是Fe |
| C、若丁是CO2,则甲可能为Mg |
| D、若丁是HCl,则甲一定是Na2CO3 |
有关糖类物质概念的叙述中,正确的是( )
| A、糖类是具有甜味的物质 |
| B、糖类是具有Cn(H2O)m通式的物质 |
| C、葡萄糖是一种单糖的主要原因是一种多羟基醛 |
| D、淀粉是一种白色粉末,本身没有甜味 |
下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A、将58.5g NaCl固体溶于1 L水中所得溶液 |
| B、将22.4L HCl气体溶于水配成1 L的溶液 |
| C、从1L 10mol/L的浓盐酸中取出的100mL溶液 |
| D、将4g NaOH固体溶于水中配成的100 mL溶液 |
 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )