题目内容
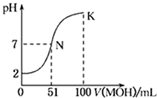 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、N点水的电离程度小于K点水的电离程度 |
| C、K点所示溶液中c(A-)>c(M+) |
| D、K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:0.01mol?L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和.
解答:
解:A.0.01mol?L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,故A错误;
B.N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故B错误;
C.K点所示溶液中,l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液100ml,反应后溶液中MOH,MA溶液,c(A-)<c(M+),故C错误;
D.在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)和c(M+)的和是原来MOH浓度的一半,故D正确;
故选D.
B.N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故B错误;
C.K点所示溶液中,l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液100ml,反应后溶液中MOH,MA溶液,c(A-)<c(M+),故C错误;
D.在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)和c(M+)的和是原来MOH浓度的一半,故D正确;
故选D.
点评:本题考查了酸碱反应的定量分析判断,掌握弱电解质电离平衡是解题关键,题目难度中等.

练习册系列答案
相关题目
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |
能用如图气体制取装置制取少量气体并能“随开随用、随关随停”的是( )

| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、过氧化钠和水制取氧气 |
某溶液中含有较大量的Cl-、OH-、CO32-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加过量Mg(NO3)2;
②滴加过量MgCl2;
③滴加过量AgNO3溶液;
④滴加过量Ba(NO3)2溶液;
⑤滴加过量BaCl2溶液;
⑥过滤.
①滴加过量Mg(NO3)2;
②滴加过量MgCl2;
③滴加过量AgNO3溶液;
④滴加过量Ba(NO3)2溶液;
⑤滴加过量BaCl2溶液;
⑥过滤.
| A、①⑥④⑥③ |
| B、②⑥⑤⑥③ |
| C、④⑥①⑥③ |
| D、⑤⑥②⑥③ |
下列物质的贮存方法,错误的是( )
| A、钠存入在煤油里 |
| B、硝酸存放在无色试剂瓶中 |
| C、生产上用铝槽车装浓硝酸 |
| D、烧碱溶液存放在橡皮塞的试剂瓶中 |