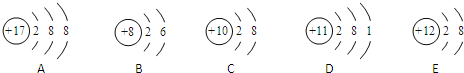题目内容
某温度下,H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
考点:化学平衡的计算
专题:化学平衡专题
分析:A、根据平衡常数计算平衡时二氧化碳的转化率,根据增加一种反应物浓度要吧提高另一种反应的转化率判断;
B、该反应是气体体积前后不变的反应,所以甲和丙为等效平衡,据此判断;
C、根据平衡常数计算平衡时二氧化碳的浓度;
D、根据影响化学反应速率的因素判断.
B、该反应是气体体积前后不变的反应,所以甲和丙为等效平衡,据此判断;
C、根据平衡常数计算平衡时二氧化碳的浓度;
D、根据影响化学反应速率的因素判断.
解答:
解:A、设甲容器中平衡时二氧化碳的浓度为xmol/L,根据K=
=2.25,得x=0.006,所以CO2的转化率为60%,H2的转化率也是60%,在乙容器中相当于是甲容器中增加了H2,CO2的转化率增大,故A错误;
B、该反应是气体体积前后不变的反应,所以甲和丙为等效平衡,平衡时,甲中和丙中H2转化率均是60%,故B正确;
C、由A的分析可知,平衡时甲容器中c(CO2)是0.004mol/L,而甲和丙为等效平衡,但丙的起始浓度为甲的两倍,所以平衡时,丙中c(CO2)是0.008mol/L,故C正确;
D、根据浓度越大反应速率越快可知,反应开始时,丙中的反应物浓度最大,所以反应速率最快,甲中的反应物浓度最小,所以反应速率最,故D正确;
故选A.
| x2 |
| (0.01-x)2 |
B、该反应是气体体积前后不变的反应,所以甲和丙为等效平衡,平衡时,甲中和丙中H2转化率均是60%,故B正确;
C、由A的分析可知,平衡时甲容器中c(CO2)是0.004mol/L,而甲和丙为等效平衡,但丙的起始浓度为甲的两倍,所以平衡时,丙中c(CO2)是0.008mol/L,故C正确;
D、根据浓度越大反应速率越快可知,反应开始时,丙中的反应物浓度最大,所以反应速率最快,甲中的反应物浓度最小,所以反应速率最,故D正确;
故选A.
点评:本题主要考查了化学平衡的相关计算、影响化学反应速率的因素、等效平衡的思想等知识点,中等难度,解题时要注意比较反应前后气体体积的变化特征.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
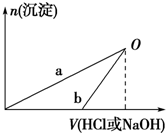 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.方案一:2.7g Al
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
已知:NaOH溶液和稀盐酸的浓度均是3mol?L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
下列物质的贮存方法,错误的是( )
| A、钠存入在煤油里 |
| B、硝酸存放在无色试剂瓶中 |
| C、生产上用铝槽车装浓硝酸 |
| D、烧碱溶液存放在橡皮塞的试剂瓶中 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
A、 若反应为2A(g)+B(g)?2C(g),则△H>0,P2>P1 |
B、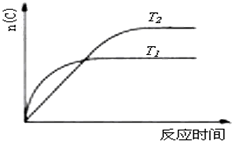 若反应为2A(g)?C(g),则△H>0,T1>T2 |
C、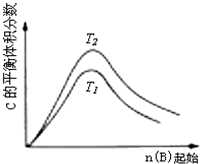 反应为3A(g)+B(g)?2C(g),则△H>0,T2>T1;或△H<0,T2<T1 |
D、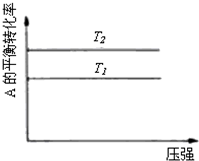 反应为A(g)+B(g)?2C(g),则△H<0,T2>T1 |
将如图所示实验装置的K闭合,下列判断正确的是( )
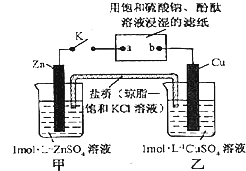

| A、片刻后可观察到滤纸b点变红色 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后甲池中c(SO42-)增大 |
| D、Cu电极上发生还原反应 |
下列关于氧化还原反应的叙述中,正确的是( )
| A、氧化还原反应的实质是元素化合价发生了变化 |
| B、氧化剂被还原,还原剂被氧化;氧化剂具有氧化性,还原剂具有还原性 |
| C、得到电子的物质被氧化,失去电子的物质被还原 |
| D、氧化还原反应中,氧化剂和还原剂一定是两种物质 |