题目内容
2.4g的镁粉在100mL稀硫酸中完全溶解(反应前后溶液体积的变化忽略不计).
(1)写出反应的离子方程式,并标出电子转移的方向和数目.
(2)求产生的气体在标准状况下的体积.
(3)求反应完全后所得溶液中镁离子的物质的量浓度.
(1)写出反应的离子方程式,并标出电子转移的方向和数目.
(2)求产生的气体在标准状况下的体积.
(3)求反应完全后所得溶液中镁离子的物质的量浓度.
考点:化学方程式的有关计算
专题:
分析:(1)镁粉在稀硫酸中发生反应Mg+H2SO4═MgSO4+H2↑,离子反应为2H++Mg=Mg2++H2↑,根据化合价的变化确定转移的电子总数2e-,标出电子转移的方向和数目;
(2)2.4g Mg 的物质的量为0.1mol,根据方程式计算生成的氢气体积;
(3)溶液中n(Mg2+)=n(Mg),根据c=
计算溶液中镁离子的物质的量浓度.
(2)2.4g Mg 的物质的量为0.1mol,根据方程式计算生成的氢气体积;
(3)溶液中n(Mg2+)=n(Mg),根据c=
| n |
| V |
解答:
解:(1)在反应Mg+H2SO4═MgSO4+H2↑中,Mg元素的化合价由0升高到+2价,则Mg为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,该反应中转移的电子数为2e-,离子反应为2H++Mg=Mg2++H2↑电子转移的方向和数目为: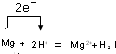 ,
,
答:该反应电子转移的方向和数目为 ;
;
(2)2.4g Mg 的物质的量为
=0.1mol,令产生的氢气在标准状况下的体积为V,则:
Mg+H2SO4=MgSO4+H2↑
1mol 22.4L
0.1mol V
所以V=
×22.4L=2.24L,
答:生的氢气在标准状况下的体积为2.24L;
(3)溶液中n(Mg2+)=n(Mg)=0.1mol,溶液体积为100mL,故c(Mg2+)=
=1mol/L,
答:溶液中镁离子的物质的量浓度为1mol/L.
 ,
,答:该反应电子转移的方向和数目为
 ;
;(2)2.4g Mg 的物质的量为
| 2.4g |
| 24g/mol |
Mg+H2SO4=MgSO4+H2↑
1mol 22.4L
0.1mol V
所以V=
| 0.1mol |
| 1mol |
答:生的氢气在标准状况下的体积为2.24L;
(3)溶液中n(Mg2+)=n(Mg)=0.1mol,溶液体积为100mL,故c(Mg2+)=
| 0.1mol |
| 0.1L |
答:溶液中镁离子的物质的量浓度为1mol/L.
点评:本题考查方程式的计算、氧化还原反应、物质的量浓度等,比较基础,注意基础知识的掌握.明确元素的化合价变化是标出电子转移的方向和数目的关键,题目难度不大.

练习册系列答案
相关题目
下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A、将58.5g NaCl固体溶于1 L水中所得溶液 |
| B、将22.4L HCl气体溶于水配成1 L的溶液 |
| C、从1L 10mol/L的浓盐酸中取出的100mL溶液 |
| D、将4g NaOH固体溶于水中配成的100 mL溶液 |
下列关于氧化还原反应的叙述中,正确的是( )
| A、氧化还原反应的实质是元素化合价发生了变化 |
| B、氧化剂被还原,还原剂被氧化;氧化剂具有氧化性,还原剂具有还原性 |
| C、得到电子的物质被氧化,失去电子的物质被还原 |
| D、氧化还原反应中,氧化剂和还原剂一定是两种物质 |
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液.下列判断不正确的是( )
②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液.下列判断不正确的是( )
| A、化合物KCrO2中Cr元素为+3价 |
| B、实验①证明Cr2O3是两性氧化物 |
| C、实验②证明氧化性:Cr2O72-<I2 |
| D、实验③证明H2O2有氧化性 |
主族元素单质及化合物在许多性质上都存在着递变规律.下列有关说法不正确的是( )
| A、卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B、氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
| C、氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
| D、最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |