题目内容
11.现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A的质子数、电子层数、最外层电子数均相等,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
(1)用元素符号表示B、C、D三种元素的电负性由低到高的顺序C<N<O.
(2)E在周期表中位置是第四周期第VIII族.
(3)E元素的+2价氧化物的熔点比+3价氧化物低 (高或低),原因是Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小.
(4)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.
①F原子的外围电子排布式为3d104S1.向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,1mol该离子中含σ键的个数为16NA.
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子:该离子中碳原子的杂化方式有sp2、sp3.
(5)BD是一种有毒气体,与单质C互为等电子体,则BD中σ键与π键个数比为1:2,为减少中毒事件的发生,可以用银氨溶液检测微量的BD,其原理与银镜反应相似,有银析出,写出银氨溶液与BD反应的化学方程式CO+2Ag(NH3)2OH→(NH4)2CO3+2Ag↓+2NH3.
(6)B单质的一种同素异形体的晶胞如图乙所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{sin\frac{109°28′}{2}}$ cm.
分析 A的质子数、电子层数、最外层电子数均相等,应为H元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,应为O元素,则C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,只能处于第三周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,故E为Fe,F为Cu,以此解答该题.
解答 解:A的质子数、电子层数、最外层电子数均相等,应为H元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,应为O元素,则C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,只能处于第三周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,故E为Fe,F为Cu,
(1)同周期元素从左到右电负性逐渐增大,电负性由低到高的顺序为C<N<O,故答案为:C<N<O;
(2)E为Fe,位于周期表第四周期第VIII族,故答案为:第四周期第VIII族;
(3)因Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小,则铁元素的+2价氧化物的熔点比+3价氧化物低,
故答案为:低; Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小;
(4)①F为Cu,原子的外围电子排布式为3d104s1 ,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,离子的结构式为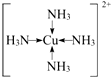 ,1mol该离子中含σ键的个数为16NA,
,1mol该离子中含σ键的个数为16NA,
故答案为:3d104S1;16NA;
②杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2、sp3;
(5)CO和氮气为等电子体,则结构式为C≡O,含有1个σ键、2个π键,个数比为1:2,可以用银氨溶液检测微量的CO,其原理与银镜反应相似,有银析出,则与银氨溶液反应的化学方程式为CO+2Ag(NH3)2OH→(NH4)2CO3+2Ag↓+2NH3,
故答案为:1:2;CO+2Ag(NH3)2OH→(NH4)2CO3+2Ag↓+2NH3;
(6)晶胞中C原子数目=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,晶胞质量=8×$\frac{12}{{N}_{A}}$g=$\frac{96}{{N}_{A}}$g,若晶体的密度为ρg/cm3,则晶胞体积=$\frac{\frac{96}{{N}_{A}}g}{ρ\;g/c{m}^{3}}$=$\frac{96}{ρ{N}_{A}}$cm3,则晶胞棱长=$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,C原子与周围4个C原子形成正四面体,该正四面体的棱长=$\root{3}{\frac{96}{ρ{N}_{A}}}$cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$×$\root{3}{\frac{12}{ρ{N}_{A}}}$cm,则晶体中最近的两个原子之间的距离=$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{sin\frac{109°28′}{2}}$cm,
故答案为:$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{sin\frac{109°28′}{2}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电负性、配合物、杂化理论、晶胞计算等,(4)中计算为易错点、难点,需要学生理解晶胞结构,具备一定的空间想象与数学计算能力,注意理解均摊法进行晶胞有关计算,难度中等.

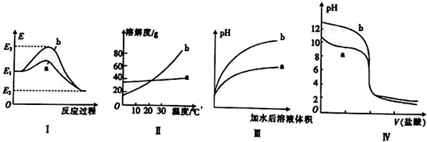
| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |
| A. | 原子最外层电子数由多到少的顺序:Z>Y>W>X | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 最高价氧化物对应水化物的酸性:W>Y |
| A. | 二氧化硅为酸性氧化物,可用于制做计算机芯片 | |
| B. | 铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 浓硫酸具有脱水性,可用于干燥NH3、SO2等 |
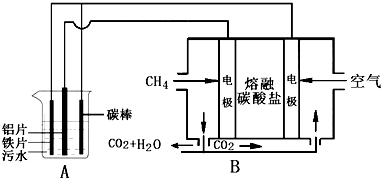
| A. | 装置B中通CH4一极电极反应为:CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 装置B中CO32-向CH4一极移动 | |
| C. | A中阳极相关反应有:Fe-2e-═Fe2+ 2H2O-4e-═4H++O2↑ 12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+ | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
| A. | 6.02×1023 | B. | 44.8 | C. | 3.01×1023 | D. | 22.4 |
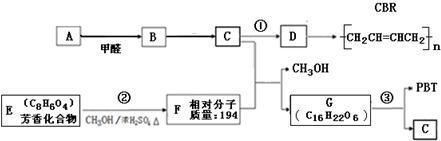
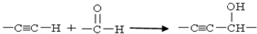
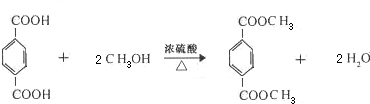 .E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是
.E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是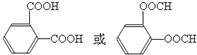 .
.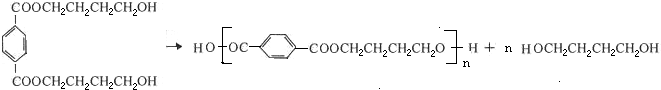 .
.