题目内容
2.短周期主族元素X、Y、Z、W原子序数依次增大,X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧.下列说法正确的是( )| A. | 原子最外层电子数由多到少的顺序:Z>Y>W>X | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 最高价氧化物对应水化物的酸性:W>Y |
分析 短周期元素X、Y、Z、W原子序数依次增大,X的质子数与电子层数相同,则X为H元素;Z的最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;Y、Z同周期且相邻,则Y为N元素;元素W在地壳中的含量仅次于氧,则W为Si,据此结合元素周期律知识解答.
解答 解:短周期元素X、Y、Z、W原子序数依次增大,X的质子数与电子层数相同,则X为H元素;Z的最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;Y、Z同周期且相邻,则Y为N元素;元素W在地壳中的含量仅次于氧,则W为Si,
A.X、Y、Z、W分别为H、N、O、Si,最外层电子数分别为1、5、6、4,则原子最外层电子数由多到少的顺序:Z>Y>W>X,故A正确;
B.X、Y、Z三种元素形成的化合物NH4NO3中含有离子键、共价键,故B错误;
C.非金属性Y(N)<Z(O),故气态氢化物稳定性:NH3<H2O,故C错误;
D.非金属性Y(N)>W(Si),故最高价含氧酸的酸性:硝酸>硅酸,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.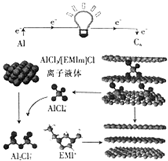 英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
 英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为Cn(AlCl4-)+e-═Cn+AlCl4- |
10.下列解释事实的方程式不正确的是( )
| A. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| B. | 用稀HNO3清洗试管内壁上的银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
17.欲配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是( )
| A. | 100mL容量瓶 | B. | 分液漏斗 | C. | 玻璃棒 | D. | 胶头滴管 |
7.某化合物丙是药物中间体,其合成路线如下:

下列有关叙述不正确的是( )

下列有关叙述不正确的是( )
| A. | 甲和丙均能使酸性高锰酸钾褪色 | |
| B. | 核磁共振氢谱可以区分乙和丙 | |
| C. | 乙与足量H2加成所得的产物分子中有2个手性碳原子 | |
| D. | 1mol甲在一定条件下最多与4 mol氢气发生加成反应 |
12.从减少环境污染的角度看,应大力推广的能源是( )
| A. | 氢能 | B. | 太阳能 | C. | 风能 | D. | 化石燃料 |

