题目内容
19.下列有关物质的性质或应用均正确的是( )| A. | 二氧化硅为酸性氧化物,可用于制做计算机芯片 | |
| B. | 铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 浓硫酸具有脱水性,可用于干燥NH3、SO2等 |
分析 A.二氧化硅为绝缘体,制做计算机芯片的材料应为半导体;
B.根据牺牲阳极的阴极保护法来保护金属;
C.根据Zn是较为活泼的金属,原电池负极失去电子分析;
D.浓硫酸做干燥剂体现吸水性,浓硫酸具有酸性不能干燥碱性气体.
解答 解:A.硅为良好的半导体材料,用于制做计算机芯片,故A错误;
B.因要减缓船体的腐蚀应连接比铁更活泼的金属,如锌,这就是牺牲阳极的阴极保护法,故B错误;
C.Zn是较为活泼的金属,具有较强的还原性,可作为锌锰干电池的负极材料,故C正确;
D.浓硫酸做干燥剂体现吸水性,浓硫酸具有酸性不能干燥碱性气体,所以浓硫酸不能干燥氨气,故D错误;
故选:C.
点评 本题考查了元素化合物知识,侧重考查物质的性质与用途,金属的腐蚀与防护,明确相关物质的性质、熟悉原电池工作原理即可解答,题目难度不大.

练习册系列答案
相关题目
9.下列实验方案中,能达到相应实验目的是( )
| A | B | C | D | |
| 方案 | 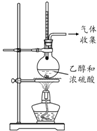 |  | 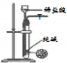 | 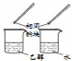 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
10.下列解释事实的方程式不正确的是( )
| A. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| B. | 用稀HNO3清洗试管内壁上的银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
7.某化合物丙是药物中间体,其合成路线如下:

下列有关叙述不正确的是( )

下列有关叙述不正确的是( )
| A. | 甲和丙均能使酸性高锰酸钾褪色 | |
| B. | 核磁共振氢谱可以区分乙和丙 | |
| C. | 乙与足量H2加成所得的产物分子中有2个手性碳原子 | |
| D. | 1mol甲在一定条件下最多与4 mol氢气发生加成反应 |
4.下列说法正确的是( )
| A. | 前四周期中最外层电子数大于或等于3的元素一定是主族元素 | |
| B. | 冰中水分子空隙大于4℃液态水、近沸点水蒸汽中存在(H2O)n与形成配位键有关 | |
| C. | 化合物中某元素为+1价,则表明失去了1个电子且带1个单位正电荷 | |
| D. | 在化学反应中,原子首先失去的电子能量最低 |
8.在春暖花开的季节,广州处处鸟语花香,这里的“花香”体现的化学知识是( )
| A. | 分子是不可再分的 | B. | 分子只有在特定的季节才会运动 | ||
| C. | 分子是不停运动的 | D. | 分子只有在特定的空间才会运动 |
