题目内容
15.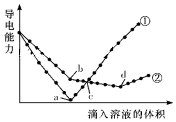 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )| A. | ②代表滴加H2SO4溶液的变化曲线 | |
| B. | b点溶液中大量存在的离子是SO42-、Na+、OH- | |
| C. | a、d两点对应的溶液均显中性 | |
| D. | c点两溶液中含有相同量的OH- |
分析 A.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应;
B.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH;
C.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4;
D.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4.
解答 解:A.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,即①代表滴加H2SO4溶液的变化曲线,故A错误;
B.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,溶液溶质为NaOH,所以b点溶液中大量存在的离子是OH-、Na+,故B错误;
C.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4,水和硫酸钠溶液都呈中性,故C正确;
D.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4,因为硫酸根离子浓度相同,②中钠离子浓度大于①中氢离子浓度,所以溶液中氢氧根离子浓度不同,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及识图能力,明确发生的反应及各点溶液中溶质成分是解本题关键,注意:溶液导电能力与离子浓度成正比,易错选项是B.

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| B. | 在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声 | |
| C. | 制氧气时排水法收集氧气后出现倒吸现象,应立即松开试管上的橡皮塞 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
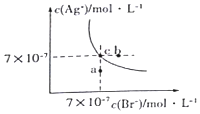 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 图中a点对应的是AgBr的不饱和溶液 | |
| B. | 在t°C时,AgBr的Ksp为 4.9×10-13 | |
| C. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| D. | 在t°C时,AgCl(s)+Br-(aq)?AgBr(s)+C1-(aq)的平衡常数K≈816 |
| A.图装置中X为苯,可用于吸收NH3或HCl,并防止倒吸 | B.图装置可用于铜与浓硫酸反应制取并收集二氧化硫 | C.图装置可用于硫酸铜溶液的蒸发浓缩,然后冷却制硫酸铜晶体 | D.记录滴定终点读数为12.20mL |
 | 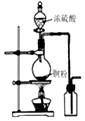 | 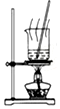 | 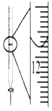 |
| A. | A | B. | B | C. | C | D. | D |
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |