题目内容
5.化学实验设计和操作中必须十分重视安全和环境.下列实验问题处理方法正确的是( )| A. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| B. | 在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声 | |
| C. | 制氧气时排水法收集氧气后出现倒吸现象,应立即松开试管上的橡皮塞 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
分析 A.废液倒入下水道,造成水污染;
B.排空气法不能收集到纯净的CO;
C.立即松开试管上的橡皮塞,防止水进入试管发生试管炸裂;
D.试管可直接加热.
解答 解:A.实验结束后将所有的废液倒入下水道排出实验室,会污染下水道中的水造成污染,故A错误;
B.排空气法不能收集到纯净的CO,应用排水法收集,故B错误;
C.制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞,防止水进入试管发生试管炸裂,故C正确;
D.并不是所有玻璃仪器都不能直接加热,试管可直接加热,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高考常见题型和高频考点,侧重考查学生的分析能力和实验能力,注意把握安全及事故处理,难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
8.电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3•2H2O及FeO等杂质.回收废酸同时生产含铁产品的流程如图:
已知:i.酸洗钢制构件后得到废酸的主要成分如表所示.
ii pH<4时,Fe2+不易被氧气氧化.
(1)酸洗钢制构件时发生反应的离子方程式:2H++FeO=Fe2++H2O、6H++Fe2O3•H2O+Fe═3Fe2++4H2O.
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)?FeSO4(s)+2HCl( aq).
①加入过量H2SO4的作用是抑制Fe2+水解:防止pH>4时,Fe2+被氧气氧化:同时提供H+利于HC1气体的逸出;提供SO42-利于FeSO4固体析出(至少写出两点).
②用化学平衡原理解释鼓入空气的目的:空气带走HCl气体,促进平衡FeCl2(s)+H 2SO4(aq)?FeSO4(s)+2HCl(aq)向正反应方向移动,有利于FeSO4固体的析出.
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是2FeSO4$\frac{\underline{\;焙烧\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)过程IV发生反应的离子方程式是2Fe2++H2O2+8Cl-+2H+═2FeCl4-+2H2O.
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH+X- $?_{脱附}^{吸附}$RX+OH-.当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-?Fe3++4C1-.
①吸附后溶液酸性下降的原因是利用阴离于空换树脂进行吸附时,树脂上的OH-被交换下来进入吸附后溶液.
②洗脱液中主要含有的溶质是FeCl3和HC1.

已知:i.酸洗钢制构件后得到废酸的主要成分如表所示.
| 成分 | Cl- | 游离HCl | Fe2+ | Fe3+ |
| 含量g•/L-1 | 130-160 | 50-70 | 60-80 | 0 |
(1)酸洗钢制构件时发生反应的离子方程式:2H++FeO=Fe2++H2O、6H++Fe2O3•H2O+Fe═3Fe2++4H2O.
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)?FeSO4(s)+2HCl( aq).
①加入过量H2SO4的作用是抑制Fe2+水解:防止pH>4时,Fe2+被氧气氧化:同时提供H+利于HC1气体的逸出;提供SO42-利于FeSO4固体析出(至少写出两点).
②用化学平衡原理解释鼓入空气的目的:空气带走HCl气体,促进平衡FeCl2(s)+H 2SO4(aq)?FeSO4(s)+2HCl(aq)向正反应方向移动,有利于FeSO4固体的析出.
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是2FeSO4$\frac{\underline{\;焙烧\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)过程IV发生反应的离子方程式是2Fe2++H2O2+8Cl-+2H+═2FeCl4-+2H2O.
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH+X- $?_{脱附}^{吸附}$RX+OH-.当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-?Fe3++4C1-.
①吸附后溶液酸性下降的原因是利用阴离于空换树脂进行吸附时,树脂上的OH-被交换下来进入吸附后溶液.
②洗脱液中主要含有的溶质是FeCl3和HC1.
16.下列说法正确的是( )
| A. | 水的摩尔质量是18g | B. | 1分子硫酸的质量是98g | ||
| C. | 1molN2的质量是28g | D. | 摩尔是七个基本物理量之一 |
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 标准状况下,22.4L的CCl4中含有CCl4分子数目为NA | |
| C. | 25℃时,1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,转移的电子数目为0.2NA |
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 | |
| B. | 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA | |
| C. | 标准状况下,11.2 L HF含有0.5 NA个HF分子 | |
| D. | 500mL 12mol.L-1的盐酸与足量 MnO2加热充分反应,生成Cl2 分子数目1.5 NA |
10.下列说法中不正确的是( )
| A. | 强酸、强碱、大多数盐是强电解质,弱酸、弱碱和水是弱电解质 | |
| B. | 电解质溶液导电性的强弱跟单位体积溶液里自由移动的离子多少有关 | |
| C. | 具有强极性共价键的化合物一定是强电解质 | |
| D. | 硫酸钠是强电解质,碳酸氢钠也是强电解质 |
17.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下44.8L乙醇(C2H5OH)含有氢原子数为12NA | |
| B. | 25°C,101KPa条件下,1.4g N2的体积大于1.12L | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和 N2的混合气体含有约3.01×1022个原子 |
14.在c(NaOH)=2c(NaAlO2)的溶液中滴加稀HCl,下列离子方程式正确的是( )
| A. | OH-+AlO2-+2H+=Al(OH)3 | B. | OH-+AlO2-+5H+=Al3++3H2O | ||
| C. | 2OH-+AlO2-+3H+=Al(OH)3+H2O | D. | OH-+2AlO2-+3H++H2O=2Al(OH)3 |
15.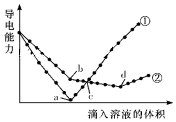 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )| A. | ②代表滴加H2SO4溶液的变化曲线 | |
| B. | b点溶液中大量存在的离子是SO42-、Na+、OH- | |
| C. | a、d两点对应的溶液均显中性 | |
| D. | c点两溶液中含有相同量的OH- |