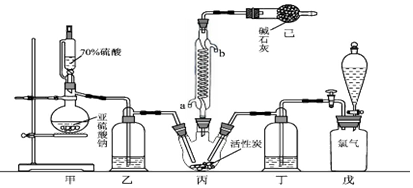
题目内容
5.下列说法正确的是( )| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
分析 A.同周期时IA族元素的金属性比IIA族元素的金属性强;
B.非金属性越强,对应氢化物的还原性越弱;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强;
D.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小.
解答 解:A.同周期时IA族元素的金属性比IIA族元素的金属性强,而Ca的金属性大于Na的金属性,故A错误;
B.非金属性越强,对应氢化物的还原性越弱,则HF、HCl、HBr、HI的还原性从左到右依次增强,故B正确;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强,而同周期非金属氧化物对应的水化物的酸性无此规律,不一定为最高价含氧酸,故C错误;
D.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则第三周期中铝离子半径最小,故D错误;
故选B.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.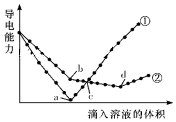 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )| A. | ②代表滴加H2SO4溶液的变化曲线 | |
| B. | b点溶液中大量存在的离子是SO42-、Na+、OH- | |
| C. | a、d两点对应的溶液均显中性 | |
| D. | c点两溶液中含有相同量的OH- |
16.下列各组离子在无色溶液中能大量共存的是( )
| A. | K+、Fe3+、Cl- | B. | Na+、CO32-、H+ | C. | Na+、HCO3-、OH- | D. | K+、AlO2-、OH- |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,1mol O2 与1mol 纯碱的体积相同 | |
| B. | 常温常压下,18g H2O所含的氧原子的数目为NA | |
| C. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| D. | 1L 水溶解58.5g NaCl 所形成的溶液的物质的量浓度是0.1mol•L-1 |
20.将固体NH4Br置于密闭容器中,在某温度下,发生反应:①NH4Br(s)?NH3(g)+HBr(g),②2HBr(g)?Br2(g)+H2(g),2min平衡后,测知H2的浓度为2mol•L-1,HBr的浓度为4mol•L-1,则在该温度下①平衡常数K是( )
| A. | 20 mol-2•L-2 | B. | 32 mol-2•L-2 | C. | 25 mol-2•L-2 | D. | 16 mol-2•L-2 |
10.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1.0 L 0.5mol/L的Na2SO4水溶液中含有的氧原子数为2NA | |
| B. | 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中,胶粒数等于0.2NA | |
| C. | 1.0g H2O与D2O的混合物所含中子数为0.5NA | |
| D. | 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为NA |
17.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压,22.4 SO3中的硫原子数目大于NA | |
| B. | 50g质量分数为34%的过氧化氢水溶液中含氧原子数目为NA | |
| C. | 5.6g Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 0.2mol AlCl3中含离子数为0.8NA |
15.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |