题目内容
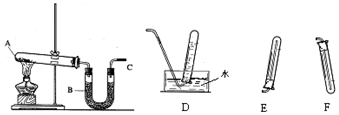
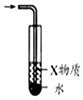
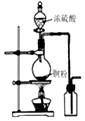
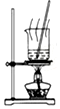
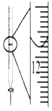
10.下列有关实验的选项正确的是( )| A.图装置中X为苯,可用于吸收NH3或HCl,并防止倒吸 | B.图装置可用于铜与浓硫酸反应制取并收集二氧化硫 | C.图装置可用于硫酸铜溶液的蒸发浓缩,然后冷却制硫酸铜晶体 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯的密度比水小,不能使极易溶于水的气体与水隔离;
B.二氧化硫的密度大于空气,应该用向上排空气法收集;
C.蒸发溶液得晶体可以在烧杯中进行;
D.滴定管的小刻度在上方,该溶液读数小于12.00mL.
解答 解:A.苯的密度比水小,不能使极易溶于水的气体与水隔离,则应将苯改为四氯化碳可吸收NH3或HCl气体,并防止倒吸,故A错误;
B.二氧化硫的密度比空气密度大,收集二氧化硫时应该伸入集气瓶的导管应该采用长进短出的方式,故B错误;
C.可以用图示装置蒸发蒸发浓缩硫酸铜溶液,然后冷却制硫酸铜晶体,故C正确;
D.滴定管的0刻度在上方,该溶液正确读数为11.6mL,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及尾气吸收、气体收集、滴定管构造、蒸发等知识,明确常见化学实验基本操作方法即可解答,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 | |
| B. | 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA | |
| C. | 标准状况下,11.2 L HF含有0.5 NA个HF分子 | |
| D. | 500mL 12mol.L-1的盐酸与足量 MnO2加热充分反应,生成Cl2 分子数目1.5 NA |
1.下列物质中,分子里的所有原子不可能在同一平面上的是( )
| A. | 乙炔 | B. | 苯甲醛 | ||
| C. | 异戊二烯 | D. | 丙烯醛(CH2=CH-CHO) |
5.下列叙述中,正确的是( )
| A. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| B. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| C. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
15.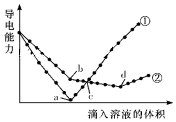 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )| A. | ②代表滴加H2SO4溶液的变化曲线 | |
| B. | b点溶液中大量存在的离子是SO42-、Na+、OH- | |
| C. | a、d两点对应的溶液均显中性 | |
| D. | c点两溶液中含有相同量的OH- |
20.将固体NH4Br置于密闭容器中,在某温度下,发生反应:①NH4Br(s)?NH3(g)+HBr(g),②2HBr(g)?Br2(g)+H2(g),2min平衡后,测知H2的浓度为2mol•L-1,HBr的浓度为4mol•L-1,则在该温度下①平衡常数K是( )
| A. | 20 mol-2•L-2 | B. | 32 mol-2•L-2 | C. | 25 mol-2•L-2 | D. | 16 mol-2•L-2 |