题目内容
4.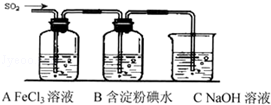 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:(1)SO2与Fe3+反应的还原、氧化产物分别是Fe2+、SO42-(填离子符号).
(2)下列实验方案可以用于在实验室制取所需SO2的是BD.
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是除去多余的SO2,防止污染空气.
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为0.25mol/L才能达到目的.
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是SO2、Fe2+都能使酸性高锰酸钾褪色.
(6)能表明I-的还原性弱于SO2的现象是B中蓝色褪去,写出有关离子方程式:I2+SO2+2H2O=4H++2I-+SO42-.
分析 (1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;
(2)实验室制取气体要考虑操作方便、易控制、不能含杂质;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(4)保证二氧化硫吸收充分,二氧化硫和氢氧化钠的反应为:SO2+NaOH=NaHSO3,据此计算解答;
(5)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析.
解答 解:(1)二氧化硫与铁离子反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,反应中铁离子被氧化成亚铁离子,所以还原产物为亚铁离子;氧化产物是SO42-,SO2气体还原Fe3+反应的产物是Fe2+、SO42-,
故答案为:Fe2+;SO42-;
(2)A.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸钠,无法得到二氧化硫气体,故A错误;
B.浓硫酸虽具有强酸性,且浓硫酸不挥发,亚硫酸钠溶液与浓硫酸能够反应生成二氧化硫气体,故B正确;
C.固体硫在纯氧中燃烧,操作不容易控制,且无法获得纯净的二氧化硫,故C错误;
D.Cu与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,可知制备二氧化硫,故D正确;
故答案为:BD;
(3)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:除去多余的SO2,防止污染大气;
(4)如果有280mL即0.0125molSO2气体(已折算为标态)进入C装置中,则C中,SO2+NaOH=NaHSO3,至少需要氢氧化钠的物质的量是0.0125mol,浓度是$\frac{0.0125mol}{0.05L}$=0.25mol/L,
故答案为:0.25;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以方案①不合理,
故答案为:方案①;因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,其反应的离子方程式为:I2+SO2+2H2O=4H++2I-+SO42-;
故答案为:B中溶液蓝色褪去;I2+SO2+2H2O=4H++2I-+SO42-.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化性还原性强弱比较、性质实验方案的设计与评价等知识,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键.

| A. | 0.1mol•L-1的NaCl溶液中Cl-的数目为0.1NA | |
| B. | 16g O2和O3的混合气体中所含的氧原子数为NA | |
| C. | 22.4L H2中含有的氢原子数一定为2NA | |
| D. | 1mol Cl2与过量的金属钠充分反应后,转移的电子数为NA |
①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.
上述四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | C>A>B>D | C. | D>B>C>A | D. | B>A>C>D |
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化⑥NH4Cl受热分解 ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
| A. |  实验室制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  实验室制乙酸乙酯 |

 ,
, +CO2+H2O→
+CO2+H2O→ +NaHCO3,
+NaHCO3, +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.

 将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)