题目内容
7.下列反应中,水作氧化剂的是( )| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CuO+H2 $\frac{\underline{\;高温\;}}{\;}$ Cu+H2O | D. | Na2O+H2O═2NaOH |
分析 水中H元素的化合价降低作氧化剂,水中O元素化合价升高,作还原剂,结合发生的化学反应分析水不是作氧化剂,以此来解答.
解答 解:A、2Na+2H2O═2NaOH+H2↑中H元素的化合价降低作氧化剂,故A正确;
B、2Na2O2+2H2O═4NaOH+O2↑中,水中的各元素化合价不变,故B错误;
C、CuO+H2 $\frac{\underline{\;高温\;}}{\;}$ Cu+H2O中水是生成物,故C错误;
D、Na2O+H2O═2NaOH中无元素化合价的变化,故D错误;
故选A.
点评 本题考查氧化还原反应,侧重氧化剂判断的考查,为高考常见题型,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
相关题目
14.下列实验装置图正确的是( )
| A. |  实验室制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  实验室制乙酸乙酯 |
15.下列关于酯化反应说法正确的是( )
| A. | 用CH3CH218OH与CH3COOH发生酯化反应,生成H218O | |
| B. | 反应液混合时,顺序为先倒乙醇再倒浓硫酸最后倒乙酸 | |
| C. | 乙酸乙酯不会和水生成乙酸和乙醇 | |
| D. | 用蒸馏的方法从饱和Na2CO3溶液中分离出乙酸乙酯 |
12.当氨完全分解成氮气和氢气时,混合气体对空气的相对密度为( )
| A. | 1.17 | B. | 0.74 | C. | 0.293 | D. | 1.03 |
2.下列化学式仅代表一种物质的是( )
| A. | CH4O | B. | C3H8O | C. | C3H6 | D. | C2H4O2 |
17.下列各表述与如图所示一致的是( )
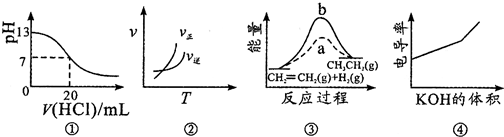

| A. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应A2(g)+3B2(g)?2AB3(g)△H<0 | |
| C. | 图③中a、b曲线分别表示反应CH2═CH2(g)+H2(g)═CH3CH3(g)△H<0,使用和未使用催化剂时反应过程中的能量变化 | |
| D. | 电导率是衡量电解质溶液导电能力大小的物理量,图④表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图 |
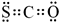 .
.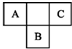 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).