题目内容
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
分析 A、反应KIO3+6HI=KI+3I2+3H2O转移5mol电子生成3mol碘单质;
B、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
C、求出混合气体的物质的量,然后根据二氧化硫和二氧化碳中均含2个氧原子来分析;
D、氯气反应后的价态不明确.
解答 解:A、反应KIO3+6HI=KI+3I2+3H2O转移5mol电子生成3mol碘单质,即当生成3mol碘单质时转移5NA个电子,故A错误;
B、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.1NA个阴离子,故B错误;
C、标况下2.24L混合气体的物质的量为0.1mol,而二氧化硫和二氧化碳中均含2个氧原子,故0.1mol混合物中含0.2NA个氧原子,故C正确;
D、氯气反应后的价态不明确,故0.1mol氯气反应后转移的电子数无法确定,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
16.向含有下列四种离子的溶液中加入少量过氧化钠固体,离子浓度未发生明显变化的是( )
| A. | HCO3- | B. | SO${\;}_{4}^{2-}$ | C. | NH${\;}_{4}^{+}$ | D. | Fe2+ |
13.1mol某金属与含3mol HNO3的稀硝酸恰好完全反应,则该金属可能是( )
| A. | Fe | B. | Al | C. | Cu | D. | Ag |
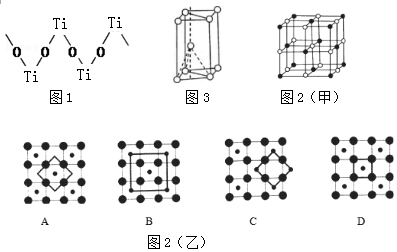
 已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是中学常见的强酸,D的浓溶液与铜共热可生成A:F的浓度液与X共热通常用于中学实验室制备单质C:B和X混合是实验室常温下简易制单质E的一种方法,X是一种黑色粉末,B的分子中有18个电子.反应中部分生成物略去,试回答下列问题:
已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是中学常见的强酸,D的浓溶液与铜共热可生成A:F的浓度液与X共热通常用于中学实验室制备单质C:B和X混合是实验室常温下简易制单质E的一种方法,X是一种黑色粉末,B的分子中有18个电子.反应中部分生成物略去,试回答下列问题: ,
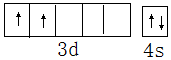
,

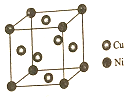 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: