题目内容
7.以下转化不能通过一步反应实现的是( )| A. | Al2O2→Al(OH)3 | B. | Al→NaAlO2 | C. | Fe→FeCl2 | D. | Na→NaOH |
分析 A、氧化铝不溶于水,也不与水反应;
B、铝与氢氧化钠反应生成NaAlO2;
C、铁能与FeCl3反应生成FeCl2;
D、Na能与水反应生成NaOH.
解答 解:A、因氧化铝不溶于水,也不与水反应,则不能一步反应实现转化,应氧化铝与氢氧化钠反应后通入足量二氧化碳来生成氢氧化铝,故A选;
B、铝与氢氧化钠反应生成NaAlO2,能一步反应生成,故B不选;
C、铁与氯化铁反应一步转化为氯化亚铁,故C不选;
D、钠和水反应生成氢氧化钠,能一步反应生成,故D不选;
故选A.
点评 本题考查物质的转化,明确物质的化学性质及相关的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
3.将20g A、20g B及20g C混合,完全反应后,得9g B,24.5g C,还有D.已知D的摩尔质量为106g•mol-1.现将44g A和44g B反应,生成D的物质的量为( )
| A. | 0.5mol | B. | 0.55mol | C. | 1mol | D. | 2mol |
18.Al溶于NaOH溶液中,Al失去1mol e-时,消耗的氧化剂为( )
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
2.向一定量的铁铜混合粉末中加入稀硝酸,充分反应后,下列说法正确的是( )
| A. | 若硝酸有剩余,溶液中存在的金属阳离子有Fe2+、Cu2+ | |
| B. | 若硝酸有剩余,溶液中存在的金属阳离子可能是Fe3+、Cu2+ | |
| C. | 若金属与硝酸均无剩余,溶液中存在的金属阳离子有Fe3+、Fe2+、Cu2+ | |
| D. | 若金属有剩余,剩余金属中一定有铁 |
12.为了提纯表所列物质(括号内为杂质),有关除杂试剂盒分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
19.常温下,将0.1L0.1mol/L Na2S2O3溶液与一定量的pH=2的硫酸溶液混合,放出VL气体.NA代表阿伏加德罗常数的值,下列说法正确的足( )
| A. | pH=2的硫酸溶液含有H+数目为0.0lNA | |
| B. | 该反应释放SO2分子数目为$\frac{V}{22.4}$NA | |
| C. | 反应中每摩尔Na2S2O3转移的电子数目为4NA | |
| D. | 若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA |
16.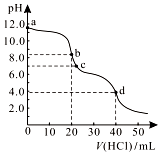 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )| A. | a点溶液呈碱性的原因用离子方程式表示为:CO32-+2H2O?H2CO3+2OH- | |
| B. | c点处的溶液中c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| C. | 滴定过程中使用甲基橙作为指示剂比酚酞更准确 | |
| D. | d点处溶液中水电离出的c(H+)大于b点处 |