题目内容
11.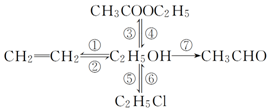 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.化学方程式:反应类型:
①CH2=CH2+H2O $\stackrel{催化剂}{→}$CH3CH2OH加成反应
②CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O消去反应
③C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O酯化反应
④CH3COOC2H5+H2O$\stackrel{△}{→}$C2H5OH+CH3COOH水解反应
⑤C2H5OH+HCl→C2H5Cl+H2O取代反应
⑥C2H5Cl+NaOH $→_{△}^{水}$C2H5OH+NaCl水解反应
⑦2C2H5OH+O2$→_{△}^{铜}$2CH3CHO+2H2O氧化反应.
分析 根据各物质相互转化的关系可知,
①乙烯与水加成生成乙醇;
②乙醇在浓硫酸条件下发生消去生成乙烯;
③乙醇与乙酸在浓硫酸条件下发生酯化反应;
④乙酸乙酯水解得乙醇;
⑤乙醇在一定条件下发生取代反应生成氯乙烷;
⑥氯代烃在碱性条件下水解生成醇;
⑦乙醇催化氧化得到乙醛.
解答 解:根据各物质相互转化的关系可知,
①乙烯与水加成生成乙醇,反应方程式为CH2=CH2+H2O $\stackrel{催化剂}{→}$CH3CH2OH,是加成反应;
②乙醇在浓硫酸条件下发生消去生成乙烯,反应方程式为CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,是消去反应;
③乙醇与乙酸在浓硫酸条件下发生酯化反应,反应方程式为C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,是酯化反应;
④乙酸乙酯水解得乙醇,反应方程式为CH3COOC2H5+H2O$\stackrel{△}{→}$C2H5OH+CH3COOH,是水解反应;
⑤乙醇在一定条件下发生取代反应生成氯乙烷,反应方程式为C2H5OH+HCl→C2H5Cl+H2O,是取代反应;
⑥氯代烃在碱性条件下水解生成醇,反应方程式为C2H5Cl+NaOH $→_{△}^{水}$C2H5OH+NaCl,是水解反应;
⑦乙醇催化氧化得到乙醛,反应方程式为2C2H5OH+O2$→_{△}^{铜}$2CH3CHO+2H2O,是氧化反应,
故答案为:CH2=CH2+H2O $\stackrel{催化剂}{→}$CH3CH2OH;加成反应;CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;消去反应;C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;酯化反应;CH3COOC2H5+H2O$\stackrel{△}{→}$C2H5OH+CH3COOH;水解反应;C2H5OH+HCl→C2H5Cl+H2O;取代反应;C2H5Cl+NaOH $→_{△}^{水}$C2H5OH+NaCl;水解反应;2C2H5OH+O2$→_{△}^{铜}$2CH3CHO+2H2O;氧化反应.
点评 本题考查了化学方程式的书写,明确乙醇的结构和性质是解题的关键,注意标注化学反应的条件,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
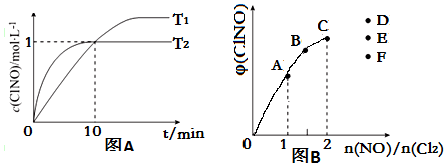
①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$,该反应为放热反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 1000 | 1 | 2 | c | d | t |
②通过计算可知,CO的转化率实验A大于 实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t小于3(填“大于”、“等于”或“小于”)