题目内容
13.实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷,石墨,氢气燃烧的反应热:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/molC(石墨)+O2(g)═CO2(g)△H2=-393.5kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol,则由石墨生成甲烷的反应热:
C(石墨)+2H2(g)═CH4(g)△H4=-74.8kJ/mol.
分析 已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H3=-285.8kJ/moL,反应C(石墨,s)+2H2(g)=CH4(g)可以是②+2×③-①得到,由此分析解答.
解答 解:已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H3=-285.8kJ/moL,反应C(石墨,s)+2H2(g)=CH4(g)可以是②+2×③-①得到,所以焓变△H=(-393.5kJ/mol
)+2×(-285.8kJ/moL)-(-890.3kJ/mol)=-74.8kJ/mol,即C(石墨,s)+2H2(g)=CH4(g)△H4=-74.8kJ/mol,
故答案为:-74.8kJ/mol.
点评 本题考查了用盖斯定律进行有关反应热的计算,难度不大,首先写出热化学方程式的方程式部分,然后以该方程式为目标对已知热化学方程式进行变形.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
3.亚硝酸氯(ClNO)是有机合成中的重要试剂.亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g).
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
n=2;k=4.0×10-7mol-1•L•s-1(注明单位).
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
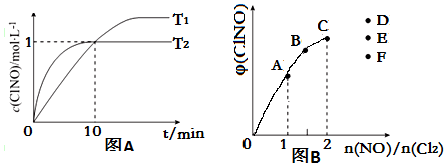
①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:

①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
1.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$,该反应为放热反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)?CO2(g)+H2(g),得到如表三组数据:
①实验B中平衡时H2O (g)的物质的量是0.6mol.
②通过计算可知,CO的转化率实验A大于 实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t小于3(填“大于”、“等于”或“小于”)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$,该反应为放热反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 1000 | 1 | 2 | c | d | t |
②通过计算可知,CO的转化率实验A大于 实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t小于3(填“大于”、“等于”或“小于”)
8. 已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
【观察与思考】
(1)乙醇分子的核磁共振氢谱有3个吸收峰.
【活动与探究】
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.
请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不规定填满).
(3)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次,写出发生反应的化学方程式:2CH3CH2OH+O22$→_{△}^{Cu}$CH3CHO+2H2O;欲验证此实验的有机产物,可以将产物加入盛有新制的氢氧化铜悬浊液的试管中并在酒精灯火焰上直接加热煮沸,可观察到有砖红色沉淀产生.
【交流与讨论】
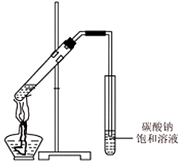
(4)丙同学向一支试管中加入3mL 乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按如图所示连接好装置,
请指出该装置的主要错误是导管插入到饱和碳酸钠溶液中,写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;饱和碳酸钠溶液在本实验的作用是除去乙酸乙酯中的乙酸和乙醇.
 已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.【观察与思考】
(1)乙醇分子的核磁共振氢谱有3个吸收峰.
【活动与探究】
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.
请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不规定填满).
| 实验现象 | 结 论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
【交流与讨论】
(4)丙同学向一支试管中加入3mL 乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按如图所示连接好装置,
请指出该装置的主要错误是导管插入到饱和碳酸钠溶液中,写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;饱和碳酸钠溶液在本实验的作用是除去乙酸乙酯中的乙酸和乙醇.
18.溶液、胶体和浊液这三种分散系的根本区别是( )
| A. | 外观 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |
2. 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | NH3 | HI | NO |
| 气体N | SO2 | HCl | Cl2 | O2 |
| A. | ③=④>①>② | B. | ③>④>①>② | C. | ④>③>②>① | D. | ④>③>①>② |
 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有: