题目内容
6.氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵.
①写出磷酸主要的电离方程式H3PO4
 H2PO4-+H+.
H2PO4-+H+.②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,则x=3n+1(用n表示).
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
□H2PO2-+□Ag++□6OH-=□PO43-+□Ag+□4H2O
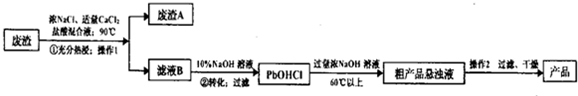
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如图1:
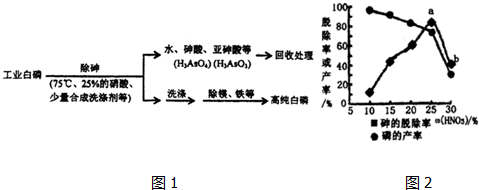
①除砷过程在75℃下进行,其合理的原因是cd(填字母).
a.使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越少(填“多”或“少”).
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图2,砷的脱除率从a点到b点降低的原因是硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低.
(4)银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)该反应平衡常数的表达式K=$\frac{c[Ag(N{H}_{3})_{2}]^{+}}{c(A{g}^{+})×{c}^{2}(N{H}_{3})}$,已知某温度下,K=1.10×107,Ksp[AgCl]=1.45×10-10,计算得到可逆反应AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.6×10-3(保留2位有效数字),1L lmol/L氨水中最多可以溶解AgCl0.04mol(保留1位有效数字).
分析 (1)①磷酸属于弱电解质,第一步电离为主;
②根据化合价代数和为0计算;
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,结合电荷守恒、原子守恒配平;
(3)①白磷不溶于水,熔化不能改变其毒性,提高温度可以加快反应速率,但温度过高,硝酸会分解;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷;
(4)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),故该反应平衡时为前两者平衡常数之积;
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,结合平衡常数计算解答.
解答 解:(1)①磷酸属于弱电解质,第一步电离为主,磷酸主要的电离方程式:H3PO4 H2PO4-+H+,
H2PO4-+H+,
故答案为:H3PO4 H2PO4-+H+;
H2PO4-+H+;
②根据化合价代数和为0,则(n+2)+5n-2x=0,故x=3n+1,
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,平衡后方程式为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O,
故答案为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O;
(3)①a.白磷不溶于水,故a错误;
b.熔化不能改变其毒性,故b错误;
c.温度过高,硝酸会分解,需要控制合适的温度,故c正确;
d.提高温度可以加快反应速率,故d正确.
故选:cd;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少,
故答案为:少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低,
故答案为:硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低;
(4)Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)的平衡常数的表达式K=$\frac{c[Ag(N{H}_{3})_{2}]^{+}}{c(A{g}^{+})×{c}^{2}(N{H}_{3})}$,
Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=$\frac{c[Ag(N{H}_{3})_{2}]^{+}×c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c[Ag(N{H}_{3})_{2}]^{+}}{c(A{g}^{+})×{c}^{2}(N{H}_{3})}$×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故
$\frac{x×x}{(1-2x)^{2}}$=1.6×10-3,解得x=0.04,
故答案为:$\frac{c[Ag(N{H}_{3})_{2}]^{+}}{c(A{g}^{+})×{c}^{2}(N{H}_{3})}$;1.6×10-3;0.04.
点评 本题考查物质制备工艺流程、氧化还原反应配平、平衡常数有关计算、电离方程式书写等,属于拼合型题目,侧重考查学生分析计算能力、知识迁移运用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
| 实验步骤 | 解释或实验结论 |
| (1)称取M 4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)M的摩尔质量为:90g/mol. |
| (2)将此4.5g M在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | (2)M的分子式为:C3H6O3. |
| (3)通过M的红外光谱图发现该分子中既有羟基,还有羧基(--COOH) | (3)写出M中含有官能团羟基的电子式: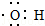 |
(4)M的核磁共振氢谱如图: | (4)M中含有4种氢原子. |
(5)综上所述,M的结构简式为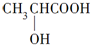 . . | |
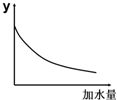
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
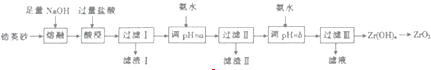
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2,Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如表?
| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(2)滤渣I的主要成分的名称为硅酸
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是除去Fe3+、Al3+
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为2NH4++CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$Ca2++2NH3↑+CO2↑+H2O.
| A. | AlCl3溶液中通过量氨气:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+3H2O | |
| C. | 氢氧化钠溶液中通过量二氧化硫:SO2+2OH-═SO32-+H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| A. | 原子序数:X<Y<Z<W | B. | 单质的熔点:W>Z | ||
| C. | 热稳定性:H2Y>HX | D. | 碱性:W(OH)2>ZOH |