题目内容
18.PbO主要用于电子管、显像管、光学玻璃和防X射线的铅玻璃的原料,它是一种难溶于水,密度较大的固体.某工业废渣(经测定含PbS04 35%,其余为硫酸钙)可用来生产PbO.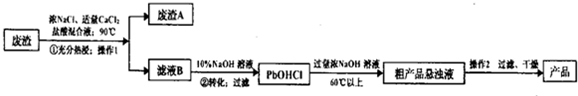
已知:
倾析法:从液体中分离出密度较大且不溶的固体的方法,即待沉淀沉降,将上层溶液倾倒入另一容器的方法.根据以上流程回答下列问题:
(1)PbSO4在热的浓氯化钠溶液中会溶解生成PbCl42-,完成①中反应的离子方程式PbSO4+4Cl-=PbCl42-+SO42-,操作1用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)用化学平衡移动原理解释步骤1中CaCl2溶液的作用增大氯离子浓度,同时结合生成的SO42-,使平衡向生成PbCl42-的方向移动,提高反应物的转化率.
(3)废渣A的主耍成分为CaSO4 或CaSO4•2H2O.(写化学式)
(4)写出“②转化”的离子方程式PbCl42-+OH-=PbOHCl↓+3Cl-.
(5)已知浓NaOH溶液有强烈的腐蚀性,会腐蚀滤纸.操作2分两步进行,依次为倾析、水洗.
(6)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA (用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,则产品中PbO的纯度为92.5%.(已知:Pb2++H2Y=PbY+2H+)
分析 PbSO4不溶,CaSO4 微溶,PbSO4在热的浓氯化钠溶液中会溶解生成PbCl42-,氯化钙可以增大氯离子浓度,同时结合生成的SO42-转化为CaSO4 沉淀,使平衡向生成PbCl42-的方向移动,过滤分离,滤渣A为硫酸钙,滤液B中加入NaOH溶液过滤得到PbOHCl沉淀,再加入浓NaOH溶液,中和HCl生成PbO,再经过过滤、干燥得到PbO.
(5)浓NaOH溶液有强烈的腐蚀性,会腐蚀滤纸,采取倾析法分离,然后进行水洗;
(6)由Pb元素守恒及Pb2++H2Y=PbY+2H+可得关系式:PbO~Pb2+~H2Y,结合关系式计算.
解答 解:PbSO4不溶,CaSO4 微溶,PbSO4在热的浓氯化钠溶液中会溶解生成PbCl42-,氯化钙可以增大氯离子浓度,同时结合生成的SO42-转化为CaSO4 沉淀,使平衡向生成PbCl42-的方向移动,过滤分离,滤渣A为硫酸钙,滤液B中加入NaOH溶液过滤得到PbOHCl沉淀,再加入浓NaOH溶液,中和HCl生成PbO,再经过过滤、干燥得到PbO.
(1)PbSO4在热的浓氯化钠溶液中会溶解生成PbCl42-,①中反应的离子方程式:PbSO4+4Cl-=PbCl42-+SO42-,操作1为过滤,用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:PbSO4+4Cl-=PbCl42-+SO42-;漏斗、玻璃棒;
(2)步骤1中CaCl2溶液的作用:增大氯离子浓度,同时结合生成的SO42-,使平衡向生成PbCl42-的方向移动,提高反应物的转化率,
故答案为:增大氯离子浓度,同时结合生成的SO42-,使平衡向生成PbCl42-的方向移动,提高反应物的转化率;
(3)废渣A的主要成分为:CaSO4 或CaSO4•2H2O,
故答案为:CaSO4 或CaSO4•2H2O;
(4)滤液中PbCl42-与入NaOH溶液的反应生成PbOHCl沉淀,还得到氯离子,“②转化”的离子方程式为:PbCl42-+OH-=PbOHCl↓+3Cl-,
故答案为:PbCl42-+OH-=PbOHCl↓+3Cl-;
(5)浓NaOH溶液有强烈的腐蚀性,会腐蚀滤纸,不能用过滤方法分离,采取倾析法分离,然后进行水洗,
故答案为:倾析;水洗;
(6)由Pb元素守恒及Pb2++H2Y=PbY+2H+可得关系式:PbO~Pb2+~H2Y,
设产品中PbO的纯度为a,则:
PbO~~Pb2+~~~H2Y
223g 1mol
0.4a g 0.2000mol/L×8.30×10-3 L
所以:223:0.4a g=1mol:0.2000mol/L×8.30×10-3 L
解得a=92.5%
故答案为:92.5%.
点评 本题考查物质制备工艺流程,涉及陌生方程式书写、物质分离提纯实验操作、对操作与原理的分析评价、产率计算等,需要学生具备扎实的基础与灵活运用的能力,是高考常考题型.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 摩尔是一种国际基本物理量 | |
| B. | 1mol氢气的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体所含分子数相同 | |
| D. | 标准状况下,1mol任何物质的体积都约为22.4L |
 实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下: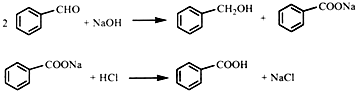
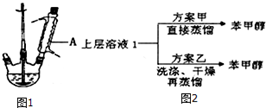
主要反应仪器如图1:
主要物质的物理常数如下表:
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 熔点 (℃) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 179.6 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 针状结晶 | 1.27 | 122.1 | 249 | 0.21g | 46.6g | 66g |
| 苯甲醇 | 108 | 无色液体 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | 无色液体 | 0.71 | -116.3 | 34.6 | 不溶 | 易溶 | 一 |
①向反应容器中加入5.0g氢氧化钠、10.0mL水和15.0mL苯甲醛.开启搅拌器,加热回流约40min.
②停止加热,向反应物中加入足够量的水,不断摇动,使其中的苯甲酸盐全部溶解.冷却后将反应容器中的液体倒入分液漏斗,加入乙醚进行萃取、分液,得到上层溶液1和下层溶液2.上层溶液1可以经过图2两种方案得到苯甲醇.
③向下层溶液2中加入浓盐酸,并进行操作Ⅰ,得到苯甲酸.
根据以上步骤回答下列问题:
(1)仪器A的名称是球形冷凝管.
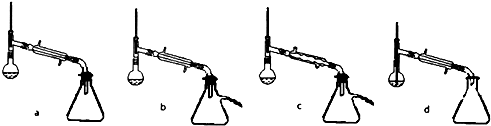
(2)上层溶液1蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热.油浴加热).蒸馏操作中,下列装置最好的是b(填标号).
(3)方案乙比方案甲得到的产品纯度更高,方案乙洗涤时先后用到了饱和NaHSO3溶液、10%的Na2CO3溶液和水.
a.饱和NaHSO3溶液的作用是除去苯甲醛.
b.加入10%的Na2CO3溶液至无气泡产生时说明杂质已被除尽.
(4)蒸馏获得苯甲醇操作时温度应控制在205.7℃左右.获得苯甲酸时进行的操作Ⅰ的名称是过滤.
(5)若制得苯甲酸的质量为7.50g.则苯甲酸的产率是81.97%.
| 序号 | ① | ② | ③ |
| 分子式 | C9H12 | C3H7OCl | C5H12O |
| 限定条件 | 芳香烃 | 含有羟基 | 不能与Na反应放出氢气 |
| A. | ③②① | B. | ②③① | C. | ③①② | D. | ②①③ |
 H2PO4-+H+.
H2PO4-+H+.
 与1-己炔 ⑦
与1-己炔 ⑦ 和
和 ⑧
⑧ 和
和
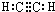 、C的结构简式:CH2=CH-CH=CH2、E的键线式:
、C的结构简式:CH2=CH-CH=CH2、E的键线式: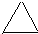 .
.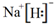 ,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)
,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)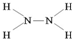 .W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.
.W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.