题目内容
15.下列有关离子方程式正确的是( )| A. | AlCl3溶液中通过量氨气:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+3H2O | |
| C. | 氢氧化钠溶液中通过量二氧化硫:SO2+2OH-═SO32-+H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
分析 A.不符合反应客观事实;
B.铁过量,反应生成硝酸亚铁;
C.二氧化硫过量,反应生成亚硫酸氢钠;
D.氯水足量,二价铁离子、溴离子都被氧化.
解答 解:A.AlCl3溶液中通过量氨气反应生成氢氧化铝和氯化铵,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.过量铁与稀硝酸反应,离子方程式:3Fe+8H++NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.氢氧化钠溶液中通过量二氧化硫,离子方程式:SO2+OH-═HSO3-,故C错误;
D.溴化亚铁溶液与足量氯水反应,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故D正确;
故选:D.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,注意反应为用量对反应的影响,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
相关题目
5.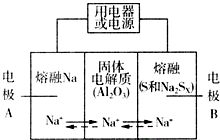 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
(1)根据上表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
10.下列有机物的同分异构体数目(不考虑立体异构)由小到大的顺序是( )
| 序号 | ① | ② | ③ |
| 分子式 | C9H12 | C3H7OCl | C5H12O |
| 限定条件 | 芳香烃 | 含有羟基 | 不能与Na反应放出氢气 |
| A. | ③②① | B. | ②③① | C. | ③①② | D. | ②①③ |
20.下列各组物质中属于纯净物的一组是( )
| A. | 不锈钢、黄铜 | B. | 24K金、铜导线 | C. | 生铁、钢 | D. | 钱币、铜钟 |
4.用20ml 0.1mol/L的含氧酸HnRO4溶液与15ml 0.2mol/L某碱M(OH)m溶液恰好完全反应,全部生成正盐,则R元素的化合价是( )
| A. | +(8-$\frac{2}{3}$m) | B. | +(8-2m) | C. | +(8-$\frac{3}{2}$m) | D. | +(8-3m) |
5.下列各对物质中属于同分异构体的是( )
| A. | 16O和18O | B. | O2与O3 | C. | CH3CH2CH3与  | D. |  与 与  |
 H2PO4-+H+.
H2PO4-+H+.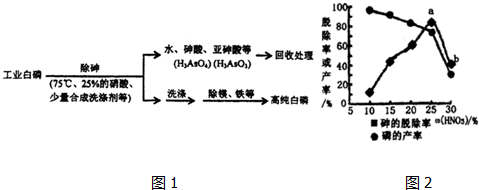
 与1-己炔 ⑦
与1-己炔 ⑦ 和
和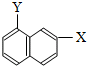 ⑧
⑧ 和
和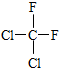
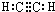 、C的结构简式:CH2=CH-CH=CH2、E的键线式:
、C的结构简式:CH2=CH-CH=CH2、E的键线式: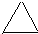 .
.