��Ŀ����
19��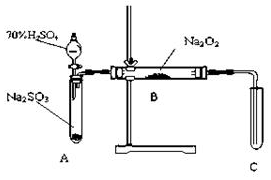 ��ѧ��ȤС��ͬѧ�������ѧϰ��˼�룬̽�������������������ķ�Ӧ��С��ͬѧ�Ľ�����ͼ��ʾ��װ�ý���ʵ����ȡSO2�ķ�Ӧ����ַ�Ӧ��B�й����ɵ���ɫ��Ϊ��ɫ��Na2O2��ȫ��Ӧ�����������ǵ�ľ�������Թ�C�У�ľ����ȼ���Իش��������⣺
��ѧ��ȤС��ͬѧ�������ѧϰ��˼�룬̽�������������������ķ�Ӧ��С��ͬѧ�Ľ�����ͼ��ʾ��װ�ý���ʵ����ȡSO2�ķ�Ӧ����ַ�Ӧ��B�й����ɵ���ɫ��Ϊ��ɫ��Na2O2��ȫ��Ӧ�����������ǵ�ľ�������Թ�C�У�ľ����ȼ���Իش��������⣺��1���������װ�øĽ��Ĵ�ʩ�����ɣ�
�ٴ�ʩ����A��B֮���һ������ܣ����ò�����������û�и��ˮ��������Na2O2��Ӧ��
�ڴ�ʩ��Ϊȷ��C�е�ʵ������������B��C֮���һ��װ��NaOH��Һ��ϴ��ƿ�����ó�ȥSO2�����ֹ��Ⱦ������
��2��ijͬѧ�ƶϸð�ɫ����ΪNa2SO3�����仯ѧ��Ӧ����ʽ��2Na2O2+2CO2=2Na2CO3+O2��
��3���κε����۶�Ҫ�������飬����ɶ�ɫ����ɷֵ�̽����
��ѡʵ���������Լ����ձ����Թܡ�ҩ�ס��ιܡ��ƾ��ơ����������ĵ��ܡ������ԹܼУ�3mol•L-1HCl��6mol•L-1HNO3��NaOHϡ��Һ������ˮ��1mol•L-1 BaCl2��Һ������ʯ��ˮ��Ʒ����Һ��
������������裺
����1����ɫ����ΪNa2SO3�� ����2����ɫ����ΪNa2SO4 ��
����3����ɫ����ΪNa2SO3��Na2SO4�Ļ���
�����ʵ�鷽��֤���������ּ��裬��������ʽд��ʵ��������衢Ԥ����������ۣ�
| ʵ����� | Ԥ����������� |
| ����1��ȡ������ɫ�������Թܣ��������3mol•L-1��ϡ���ᣬ���ϵ������������ɵ�����ͨ��Ʒ����Һ�� | ������ʹƷ����Һ��ɫ����ɫ�������ɣ�˵����ɫ���庬��Na2SO3�������1��3�������������������2������ |
| ����2���ڲ���1��Ӧ�����Һ����1mol•L-1BaCl2��Һ�� | ���а�ɫ�������ɣ���˵����ɫ���庬Na2SO4�� ��ϲ���1�Ľ��ۣ������3�������������������1������ |
���� ��1����װ��A�Ƕ�������ķ���װ�ã����ɵĶ������������к���ˮ������AB����Ҫ��һ������װ�ã�����ˮ�����Ĵ���Ӱ��̽����������������Ƶķ�Ӧ��
��װ��C����֤�������ɣ�A�����ɵĶ���������������Ⱦ�����壬�����ŷŵ������У���BC���һ������װ�ã�
��2����ȶ�����̼�������Ʒ�Ӧ����̼���ƺ����������ƶ�������������Ʒ�Ӧ�����������ƺ�������
��3�����������ƿ�֪��������������Ʒ�Ӧ�����������ƺ��������������ƺ�������Ӧ�������������ƣ��ݴ��ƶϰ�ɫ������ܵ���ɣ�
�������������ƺ����ᷴӦ���ɶ�������������֤����������ӵĴ��ڣ�������������Ӻ��Ȼ�����Һ��Ӧ�������ᱵ��ɫ������֤��������ӵĴ��ڣ�
��� �⣺��1����װ��A�Ƕ�������ķ���װ�ã����ɵĶ������������к���ˮ������AB����Ҫ��һ������װ�ã�����ˮ�����Ĵ���Ӱ��̽����������������Ƶķ�Ӧ��
�ʴ�Ϊ��������������û�и��ˮ��������Na2O2��Ӧ��
��װ��C����֤�������ɣ�A�����ɵĶ���������������Ⱦ�����壬�����ŷŵ������У���BC���һ������װ�ã���һ��ʢ������������Һ��ϴ��ƿ���ն�������
�ʴ�Ϊ��NaOH��Һ����ȥSO2���壬��ֹ��Ⱦ������
��2����̼�������Ʒ�Ӧ����̼���ƺ����������ƶ�������������Ʒ�Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2=2Na2CO3+O2��
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��
��3�����������ƿ�֪��������������Ʒ�Ӧ�����������ƺ��������������ƺ�������Ӧ�������������ƣ��ݴ��ƶϰ�ɫ������ܵ����Ϊ���������ơ������ơ��������ƺ������ƵĻ������Լ���2Ϊ����ɫ����ΪNa2SO4��
�ʴ�Ϊ����ɫ����ΪNa2SO4 ��
��������������Ӻ��Ȼ�����Һ��Ӧ�������ᱵ��ɫ������֤��������ӵĴ��ڣ������������ƺ����ᷴӦ���ɶ�������������֤����������ӵĴ��ڣ�ʵ��������Ϊ������1��ȡ������ɫ�������Թܣ��������3 mol•L-1��ϡ���ᣬ���ϵ������������ɵ�����ͨ��Ʒ����Һ��������ʹƷ����Һ��ɫ����ɫ�������ɣ�˵����ɫ���庬��Na2SO3�������1��3�������������������2������
����2���ڲ���1��Ӧ�����Һ����1 mol•L-1 BaCl2��Һ�����а�ɫ�������ɣ���˵����ɫ���庬Na2SO4����ϲ���1�Ľ��ۣ������3�������������������1������
�ʴ�Ϊ��
| ʵ����� | Ԥ����������� |
| ����3mol•L-1��ϡ��� Ʒ����Һ�� | ����ʹƷ����Һ��ɫ����ɫ�������ɣ�����1��3�� ����2 |
| 1 mol•L-1 BaCl2��Һ | �а�ɫ�������ɣ�����3 ����1 |
���� ���⿼�����������ʵ�ʵ����ƺ�ʵ����֤�����жϣ���Ŀ�Ѷ��еȣ���ȷ������������̼�����������ʵķ���Ӧ���ǽ���ؼ���������ؿ���ѧ���ķ���������������֪ʶǨ��������

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д���2C2H2��g��+5O2��g���T4CO2��g��+2H2O��1����H=-2600KJ/mol
��2C6H6��g��+15O2��g���T6CO2��g��+6H2O��1����H=-6590KJ/mol
����˵����ȷ���ǣ�������
| A�� | 2mol C2H2��g����ȫȼ��������̬ˮʱ���ȴ���2600kJ | |
| B�� | 2mol C6H6��1����ȫȼ������Һ̬ˮʱ���ȴ���6590kJ | |
| C�� | ��ͬ�����£���������C2H2��g����C6H6��g����ȫȼ�գ�C6H6��g�����ȸ��� | |
| D�� | C2H2��g����������C6H6��g���Ĺ������ڷ��ȷ�Ӧ |

| A�� | b�缫Ϊ�õ�صĸ��� | |
| B�� | b�缫������Һ��pH��С | |
| C�� | a�缫��Ӧʽ��C6H10O5-24e-+7H2O�T6CO2��+24H+ | |
| D�� | a����ĤΪ�����ӽ���Ĥ |
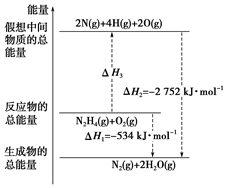 �£�H2N-NH2����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol ��ѧ�������������kJ����N��N Ϊ942��O=OΪ500��N-NΪ154�������1mol N-H �������������kJ���ǣ�������
�£�H2N-NH2����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol ��ѧ�������������kJ����N��N Ϊ942��O=OΪ500��N-NΪ154�������1mol N-H �������������kJ���ǣ�������| A�� | 194 | B�� | 391 | C�� | 516 | D�� | 685 |
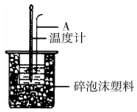 ������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�����ȡ50mL 0.25mol/L H2SO4��Һ����С�ձ��У������¶ȣ�
����ȡ50mL 0.55mol/L NaOH��Һ�������¶ȣ�
�۽�NaOH��Һ����С�ձ��У���Ͼ��Ⱥ�������Һ�¶ȣ�
��ش�
��1����ͼ��ʾ������A�������ǻ��β����������
��2������Һ���ܶȾ�Ϊ1g•cm-3���кͺ���Һ�ı�����c=4.18J•��g•�棩-1�������ʵ������д�����к��ȵ��Ȼ�ѧ����ʽ$\frac{1}{2}$H2SO4��aq��+NaOH��aq��=$\frac{1}{2}$Na2SO4��aq��+H2O��l����H=-56.0kJ/mol
 | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a��ʵ��װ�ñ��¡�����Ч����
b���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
c�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
��4����֪��CH3COOH��aq����NaOH��aq����Ӧ�ġ�H=-12.1kJ•mol-1��HCl��aq����NaOH��aq����Ӧ�ġ�H=-55.6kJ•mol-1����CH3COOH��ˮ��Һ�е���ġ�H����C
A��-67.7kJ•mol-1 B��-43.5kJ•mol-1C��+43.5kJ•mol-1 D��+67.7kJ•mol-1��
| A�� | ����ˮ��������ʯ�ҡ����� | B�� | �ϡ���ᡢ�����ᡢ�������� | ||
| C�� | ���������SO2��CO2��SiO2 | D�� | ���������CaO��Na2O2��K2O |