题目内容
(Na2SO3?7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.工业上常用硫酸厂生产的尾气来生产Na2SO3?7H2O.其生产流程可用下图表示:
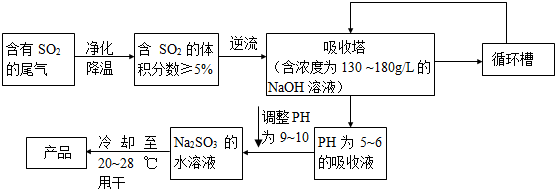
回答下列问题:
(1)净化后的含有二氧化硫的尾气在进入吸收塔时,采取逆流的原因是 .
吸收塔中NaOH的物质的量浓度范围是 .
(2)如果不调整溶液的PH为9~10可能生成的杂质是 ,调整溶液的PH为9~10所加入的物质是 .
(3)能用于测定硫酸尾气中SO2含量的是 (填字母)
A.NaOH溶液,酚酞溶液 B.KMnO4溶液,稀H2SO4
C.碘水溶液,淀粉溶液 D.氨水溶液,酚酞溶液
(4)取纯净的Na2SO3?7H2O 50.00g,经600℃以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于期望值.你认为是什么原因?(请用化学方程式表达) .

回答下列问题:
(1)净化后的含有二氧化硫的尾气在进入吸收塔时,采取逆流的原因是
吸收塔中NaOH的物质的量浓度范围是
(2)如果不调整溶液的PH为9~10可能生成的杂质是
(3)能用于测定硫酸尾气中SO2含量的是
A.NaOH溶液,酚酞溶液 B.KMnO4溶液,稀H2SO4
C.碘水溶液,淀粉溶液 D.氨水溶液,酚酞溶液
(4)取纯净的Na2SO3?7H2O 50.00g,经600℃以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于期望值.你认为是什么原因?(请用化学方程式表达)
考点:物质分离和提纯的方法和基本操作综合应用,二氧化硫的污染及治理
专题:实验设计题
分析:(1)根据接触时间长吸收更充分来分析;根据质量浓度转化成物质的量浓度;
(2)根据亚硫酸氢钠呈酸性,而亚硫酸钠呈碱性来分析;
(3)KMnO4溶液、稀H2SO4 能氧化二氧化硫,且紫色的KMnO4溶液褪色,碘与二氧化硫发生氧化还原反应,淀粉遇碘显蓝色,以此来解答;
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠.
(2)根据亚硫酸氢钠呈酸性,而亚硫酸钠呈碱性来分析;
(3)KMnO4溶液、稀H2SO4 能氧化二氧化硫,且紫色的KMnO4溶液褪色,碘与二氧化硫发生氧化还原反应,淀粉遇碘显蓝色,以此来解答;
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠.
解答:
解:(1)因为要充分吸收尾气,所以应增大接触的时间,故选用逆流的方式;又氢氧化钠的质量浓度为130-180g/L,所以物质的量浓度为
-
mol/L即3.25~4.5mol/L,故答案为:采用逆流的方式更有利于SO2的吸收;NaOH的物质的量浓度为3.25~4.5mol/L;
(2)如果不调整溶液的PH为9~10,则PH为5~6时溶液呈酸性,可能生成的杂质是亚硫酸氢钠;为了不引入新的杂质,所以调整溶液的PH为9~10所加入的物质是NaOH,故答案为:NaHSO3; NaOH;
(3)A.二氧化硫、SO3和酸雾都能与氢氧化钠溶液反应,不能用于测定,故A不符合;
B.KMnO4溶液、稀H2SO4 与二氧化硫反应的方程式为5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,二氧化硫气体和高锰酸钾反应,高锰酸钾溶液紫红色褪去,故B符合;
C.碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故C符合;
D.氨水、酚酞试液,氨水和二氧化硫反应生成亚硫酸铵,亚硫酸铵和二氧化硫和水又能反应生成亚硫酸氢铵,有两步反应,所以无法准确测定尾气中SO2含量,故D不符合;
故选BC;
(4)Na2SO3加热后发生了歧化反应生成了硫化钠,溶液中水解程度大于亚硫酸钠的水解程度,溶液碱性增强,反应的方程式为4Na2SO3=3Na2SO4+Na2S,
故答案为:4Na2SO3=3Na2SO4+Na2S,由于Na2S的碱性较强.
| 130 |
| 40 |
| 180 |
| 40 |
(2)如果不调整溶液的PH为9~10,则PH为5~6时溶液呈酸性,可能生成的杂质是亚硫酸氢钠;为了不引入新的杂质,所以调整溶液的PH为9~10所加入的物质是NaOH,故答案为:NaHSO3; NaOH;
(3)A.二氧化硫、SO3和酸雾都能与氢氧化钠溶液反应,不能用于测定,故A不符合;
B.KMnO4溶液、稀H2SO4 与二氧化硫反应的方程式为5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,二氧化硫气体和高锰酸钾反应,高锰酸钾溶液紫红色褪去,故B符合;
C.碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故C符合;
D.氨水、酚酞试液,氨水和二氧化硫反应生成亚硫酸铵,亚硫酸铵和二氧化硫和水又能反应生成亚硫酸氢铵,有两步反应,所以无法准确测定尾气中SO2含量,故D不符合;
故选BC;
(4)Na2SO3加热后发生了歧化反应生成了硫化钠,溶液中水解程度大于亚硫酸钠的水解程度,溶液碱性增强,反应的方程式为4Na2SO3=3Na2SO4+Na2S,
故答案为:4Na2SO3=3Na2SO4+Na2S,由于Na2S的碱性较强.
点评:本题考查硫酸厂生产的尾气来生产Na2SO3?7H2O的流程及其亚硫酸钠分解产物探究,注意根据目的及其流程分析反应过程,为解答该题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格是( )
| A、1000mL |
| B、950mL |
| C、900mL |
| D、500mL |

 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表: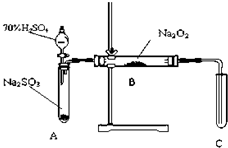 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题: