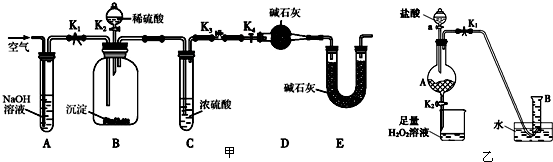
题目内容
32.5g的Zn与足量的稀盐酸完全反应,最多可收集到H2多少升(标准状况)?生成ZnCl2的物质的量是多少?
考点:化学方程式的有关计算
专题:
分析:根据n=
计算Zn的物质的量,锌与盐酸发生反应Zn+2HCl=ZnCl2+H2↑,根据方程式计算生成的氢气的物质的量和ZnCl2的物质的量,再根据V=nVm计算氢气体积.
| m |
| M |
解答:
解:32.5g锌的物质的量为
=0.5mol,
令生成的氢气的物质的量为xmol,ZnCl2的物质的为ymol,则:
Zn+2HCl=ZnCl2 +H2↑
1 1 1
0.5mol ymol xmol
所以x=0.5,y=0.5;
故标准状况下生成氢气的体积为0.5mol×22.4L/mol=11.2L,
答:标准状况下最多可收集氢气11.2L,生成ZnCl2的物质的量是0.5mol.
| 32.5g |
| 65g/mol |
令生成的氢气的物质的量为xmol,ZnCl2的物质的为ymol,则:
Zn+2HCl=ZnCl2 +H2↑
1 1 1
0.5mol ymol xmol
所以x=0.5,y=0.5;
故标准状况下生成氢气的体积为0.5mol×22.4L/mol=11.2L,
答:标准状况下最多可收集氢气11.2L,生成ZnCl2的物质的量是0.5mol.
点评:本题考查学生根据方程式的计算,比较基础,旨在考查学生对基础知识的掌握,掌握根据方程式计算的方法.

练习册系列答案
相关题目
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D、放电时的正极在充电时须接电源正极 |
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 福尔马林 | 苛性钾 | HI | 乙醇 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | HNO2 | NH3 |
| A、A、 | B、B、 | C、C、 | D、D、 |
实验室制Cl2反应为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O下列说法不正确的是( )
| ||
| A、还原剂是浓HCl,氧化剂是MnO2 |
| B、每生成1mol Cl2,转移电子2mol |
| C、每消耗1mol MnO2,浓HCl被还原4mol |
| D、转移1mol电子时,生成的Cl2在标准状况下体积为11.2 L |
镁、铝、锌、铁四种金属共20g,使其与稀硫酸恰好完全反应,将反应后所得溶液蒸干,得固体116g,则反应过程中产生气体的体积在标准状况下约为( )
| A、44.8L | B、33.6L |
| C、22.4L | D、无法确定 |
步行街口的烧烤摊常常买一些腌制类食品如:火腿、香肠等,其实在这里面一般都加了防腐剂,指( )
| A、苯甲酸钠 | B、亚硝酸钠 |
| C、味精 | D、胭脂红 |