题目内容
Ⅰ某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置.

(1)写出编号仪器的名称:① ② .
(2)浓硫酸的作用是 .
(3)本实验需要加热的装置为 (填字母编号).
(4)写出装置C、D中可观察到的现象:C ,D .
(5)D中反应每生成1mol水分子,转移的电子数为 个.
Ⅱ实验时他需要1.0mol/L的硫酸溶液250mL.根据溶液的配制回答下列问题.
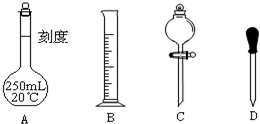
(1)在下图所示仪器中,配制上述溶液肯定不需要的是 (填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 .
(2)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀.
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好.

(1)写出编号仪器的名称:①
(2)浓硫酸的作用是
(3)本实验需要加热的装置为
(4)写出装置C、D中可观察到的现象:C
(5)D中反应每生成1mol水分子,转移的电子数为
Ⅱ实验时他需要1.0mol/L的硫酸溶液250mL.根据溶液的配制回答下列问题.

(1)在下图所示仪器中,配制上述溶液肯定不需要的是
(2)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀.
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
考点:性质实验方案的设计
专题:实验设计题
分析:Ⅰ、(1)熟悉常见化学仪器,了解名称;
(2)氢气需要进行干燥;
(3)根据反应的条件进行分析;
(4)白色无水硫酸铜吸水变色;黑色氧化铜因被还原也变色;
(5)氧化还原反应中,化合价升高元素失电子,化合价降低元素得到电子,化合价升高值=化合价降低值=转移电子数.
Ⅱ、(1)根据配制溶液的实验操作过程选择仪器;
(2)根据仪器的使用原则以及实验步骤来回答;
(3)根据稀释前后溶质的物质的量相等计算所需浓硫酸的体积.
(2)氢气需要进行干燥;
(3)根据反应的条件进行分析;
(4)白色无水硫酸铜吸水变色;黑色氧化铜因被还原也变色;
(5)氧化还原反应中,化合价升高元素失电子,化合价降低元素得到电子,化合价升高值=化合价降低值=转移电子数.
Ⅱ、(1)根据配制溶液的实验操作过程选择仪器;
(2)根据仪器的使用原则以及实验步骤来回答;
(3)根据稀释前后溶质的物质的量相等计算所需浓硫酸的体积.
解答:
解:Ⅰ、(1)熟悉常见化学仪器,了解名称.图中①锥形瓶②长颈漏斗,故答案为:锥形瓶;长颈漏斗;
(2)氢气可用浓硫酸干燥,故答案为:干燥氢气;
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,故答案为:D;
(4)C处得无水硫酸铜因吸水,由白色变为蓝色;D处得黑色氧化铜粉末在加热的条件下,被氢气还原成红色铜.颜色变化是由黑色变为红色.故答案为:白色固体变蓝;黑色粉末变红色;
(5)在反应CuO+H2
Cu+H2O中,化合价升高值=化合价降低值=转移电子数=2NA=1.204×1024,故答案为:21.204×1024;
Ⅱ、(1)配制250ml1.0mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器为:烧杯、筒量、玻璃棒、250mL容量瓶、胶头滴管,所以还需要的仪器是:烧杯、玻璃棒,故答案为:烧杯、玻璃棒;
(2)A.使用容量瓶前检验是否漏水,故正确;
B.容量瓶用水洗净后,不能再用待配溶液洗涤,有水不会影响实验结果,故错误;
C.配制溶液时,如果试样是固体,把称好的固体倒入烧杯中溶解,容量瓶不能作为溶解仪器,故错误;
D.配制溶液时,容量瓶不能作为稀释仪器,应该在烧杯中稀释,故错误;
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀,故正确.
故选BCD;
(3)设:需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为VmL,则
=1.0×0.25,解得V=13.6mL,需要15mL的量筒,
故答案为:13.6;15.
(2)氢气可用浓硫酸干燥,故答案为:干燥氢气;
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,故答案为:D;
(4)C处得无水硫酸铜因吸水,由白色变为蓝色;D处得黑色氧化铜粉末在加热的条件下,被氢气还原成红色铜.颜色变化是由黑色变为红色.故答案为:白色固体变蓝;黑色粉末变红色;
(5)在反应CuO+H2
| ||
Ⅱ、(1)配制250ml1.0mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器为:烧杯、筒量、玻璃棒、250mL容量瓶、胶头滴管,所以还需要的仪器是:烧杯、玻璃棒,故答案为:烧杯、玻璃棒;
(2)A.使用容量瓶前检验是否漏水,故正确;
B.容量瓶用水洗净后,不能再用待配溶液洗涤,有水不会影响实验结果,故错误;
C.配制溶液时,如果试样是固体,把称好的固体倒入烧杯中溶解,容量瓶不能作为溶解仪器,故错误;
D.配制溶液时,容量瓶不能作为稀释仪器,应该在烧杯中稀释,故错误;
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀,故正确.
故选BCD;
(3)设:需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为VmL,则
| V×1.84×98% |
| 98 |
故答案为:13.6;15.
点评:本题主要考查物质在化学反应中的颜色变化和如何改进实验装置、一定物质的量浓度溶液配制以及对物质的量浓度理解与计算等,属于有较大难度的题目,需要同学们细心考虑.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
镁、铝、锌、铁四种金属共20g,使其与稀硫酸恰好完全反应,将反应后所得溶液蒸干,得固体116g,则反应过程中产生气体的体积在标准状况下约为( )
| A、44.8L | B、33.6L |
| C、22.4L | D、无法确定 |