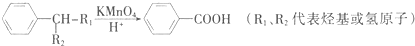题目内容
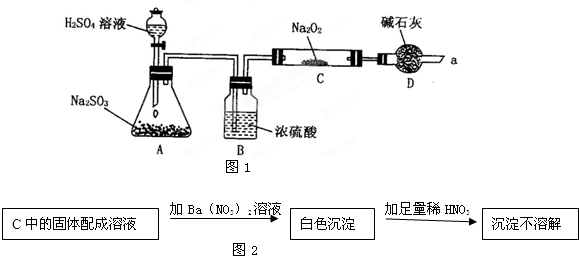
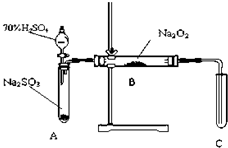 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用
②措施:为确保C中的实验现象发生,在B、C之间加一个装有
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol?L-1 HCl、6mol?L-1 HNO3、NaOH稀溶液、蒸馏水、1mol?L-1 BaCl2 溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3;
假设2:
假设3:白色固体为Na2SO3与Na2SO4 的混合物.
②设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入 | 若 |
| 步骤2:在步骤1反应后的溶液加入 | 若 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)①装置A是二氧化硫的发生装置,生成的二氧化硫气体中含有水蒸气,AB间需要加一个干燥装置,避免水蒸气的存在影响探究二氧化硫和过氧化钠的反应;
②装置C是验证氧气生成,A中生成的二氧化硫气体是污染性气体,不能排放到空气中;在BC间加一个吸收装置;
(2)类比二氧化碳和过氧化钠反应生成碳酸钠和氧气,类推二氧化硫和过氧化钠反应生成亚硫酸钠和氧气;
①依据类推可知二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应可以生成硫酸钠,据此推断白色固体可能的组成;
②利用亚硫酸钠和盐酸反应生成二氧化硫气体验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在.
②装置C是验证氧气生成,A中生成的二氧化硫气体是污染性气体,不能排放到空气中;在BC间加一个吸收装置;
(2)类比二氧化碳和过氧化钠反应生成碳酸钠和氧气,类推二氧化硫和过氧化钠反应生成亚硫酸钠和氧气;
①依据类推可知二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应可以生成硫酸钠,据此推断白色固体可能的组成;
②利用亚硫酸钠和盐酸反应生成二氧化硫气体验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在.
解答:
解:(1)①装置A是二氧化硫的发生装置,生成的二氧化硫气体中含有水蒸气,AB间需要加一个干燥装置,避免水蒸气的存在影响探究二氧化硫和过氧化钠的反应,
故答案为:产生二氧化硫没有干燥,水蒸气会与Na2O2反应;
②装置C是验证氧气生成,A中生成的二氧化硫气体是污染性气体,不能排放到空气中;在BC间加一个吸收装置,用一个盛有氢氧化钠溶液的洗气瓶吸收二氧化硫,
故答案为:NaOH溶液;除去SO2气体,防止污染空气;
(2)化碳和过氧化钠反应生成碳酸钠和氧气,类推二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
①依据类推可知二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应可以生成硫酸钠,据此推断白色固体可能的组成为:亚硫酸钠、硫酸钠、亚硫酸钠和硫酸钠的混合物,所以假设2为:白色固体为Na2SO4,
故答案为:白色固体为Na2SO4 ;
②依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;利用亚硫酸钠和盐酸反应生成二氧化硫气体验证亚硫酸根离子的存在,实验操作设计为:步骤1:取少量白色固体于试管,加入过量3 mol?L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液,若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3.则假设1或3成立,若无该现象,则假设2成立;
步骤2:在步骤1反应后的溶液加入1 mol?L-1 BaCl2溶液,若有白色沉淀生成,则说明白色固体含Na2SO4,结合步骤1的结论,则假设3成立,若无该现象,则假设1成立,
故答案为:
故答案为:产生二氧化硫没有干燥,水蒸气会与Na2O2反应;
②装置C是验证氧气生成,A中生成的二氧化硫气体是污染性气体,不能排放到空气中;在BC间加一个吸收装置,用一个盛有氢氧化钠溶液的洗气瓶吸收二氧化硫,
故答案为:NaOH溶液;除去SO2气体,防止污染空气;
(2)化碳和过氧化钠反应生成碳酸钠和氧气,类推二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
①依据类推可知二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应可以生成硫酸钠,据此推断白色固体可能的组成为:亚硫酸钠、硫酸钠、亚硫酸钠和硫酸钠的混合物,所以假设2为:白色固体为Na2SO4,
故答案为:白色固体为Na2SO4 ;
②依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;利用亚硫酸钠和盐酸反应生成二氧化硫气体验证亚硫酸根离子的存在,实验操作设计为:步骤1:取少量白色固体于试管,加入过量3 mol?L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液,若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3.则假设1或3成立,若无该现象,则假设2成立;
步骤2:在步骤1反应后的溶液加入1 mol?L-1 BaCl2溶液,若有白色沉淀生成,则说明白色固体含Na2SO4,结合步骤1的结论,则假设3成立,若无该现象,则假设1成立,
故答案为:
| 实验操作 | 预期现象与结论 |
| 过量3mol?L-1的稀盐酸; 品红溶液. | 有能使品红溶液褪色的无色气体生成;假设1或3; 假设2 |
| 1 mol?L-1 BaCl2溶液 | 有白色沉淀生成;假设3; 假设1; |
点评:本题考查了物质性质的实验设计和实验验证分析判断,题目难度中等,明确二氧化硫、二氧化碳和过氧化钠性质的分析应用是解题关键,试题侧重考查学生的分析、理解能力及知识迁移能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 福尔马林 | 苛性钾 | HI | 乙醇 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | HNO2 | NH3 |
| A、A、 | B、B、 | C、C、 | D、D、 |
步行街口的烧烤摊常常买一些腌制类食品如:火腿、香肠等,其实在这里面一般都加了防腐剂,指( )
| A、苯甲酸钠 | B、亚硝酸钠 |
| C、味精 | D、胭脂红 |