题目内容
17.25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HC1O |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为CH3COOH>H2CO3>HC1O.
(2)写出H2CO3的电离方程式:H2CO3?HCO3-+H+,HCO3-?CO32-+H+.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填宇母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升髙温度,上述4种表达式的数据增大的是ABCD.
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
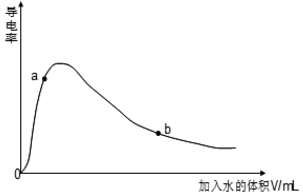
n(H+):a<b;c(CH3COO-):a>b;完全中和时消耗NaOH的物质的量:a=b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余.
分析 (1)酸的电离平衡常数越大,该酸电离程度越大,其酸性越强;
(2)碳酸为二元弱酸分步电离;
(3)醋酸为弱酸,稀释过程中醋酸的电离程度增大,溶液中氢离子、醋酸根离子的物质的量增大,醋酸的物质的量减小,由于溶液体积变化程度更大,则溶液中氢离子、醋酸根离子、醋酸的浓度减小;由于水的离子积不变,则溶液中氢氧根离子浓度增大,若该溶液升髙温度促进弱电解质电离平衡正向进行,据此进行解答;
(4)醋酸为弱酸,加水促进电离;溶液的导电能力越强,溶液中的离子浓度越大;
(5)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余,以此解答该题.
解答 解:(1)酸的电离平衡常数越大,该酸电离程度越大,其酸性越强,根据表中数据知,酸的电离程度大小顺序是CH3COOH>H2CO3>HClO>HCO3-,所以酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-,故答案为:CH3COOH>H2CO3>HClO;
(2)H2CO3为二元弱酸分步电离,碳酸的电离方程式为:H2CO3?HCO3-+H+,HCO3-?CO32-+H+,
故答案为:H2CO3?HCO3-+H+;HCO3-?CO32-+H+;
(3)A.CH3COOH溶液加水稀释过程中,由于溶液体积增大,而醋酸的电离程度较小,则稀释后溶液中c(H+)减小,故A正确;
B.稀释过程中氢离子的物质的量增大、醋酸的物质的量减小,由于在同一溶液中,溶液体积相同,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大,故B错误;
C.溶液中c(H+)•c(OH-)之积为水的离子积,稀释后溶液温度不变,则水的离子积不变,故C错误;
D.$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$为醋酸电离平衡常数表达式,平衡常数只随温度变化,不随浓度变化,故比值不变,故D错误;
故选A;
若该溶液升髙温度,促进CH3COOH、H2O电离平衡正向进行,溶液中氢离子浓度、醋酸根离子浓度增大,
A氢离子浓度增大;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大;
C.溶液中c(H+)•c(OH-)之积为水的离子积,升温促进水电离,离子积常数增大;
D.$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$为平衡常数表达式升温促进电离平衡常数增大;
上述4种表达式的数据增大的是ABCD,
故答案为:A; ABCD;
(4)醋酸为弱酸,加水促进电离,则n(H+):a<b,
溶液的导电能力越强,溶液中的离子浓度越大,则c(CH3COO-):a>b,
溶液稀释前后溶质的物质的量不变,则中和时消耗的氢氧化钠的物质的量相等,
故答案为:<;>;=;
(5)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故①错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故②错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故③正确;
④醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故④正确;
故答案为:③④;
点评 本题考查弱电解质的电离,题目难度中等,本题注意把握弱电解质的电离特点,根据相关计算公式计算,注意电离平衡常数应用.

 阅读快车系列答案
阅读快车系列答案| A. | 酸性:H3PO4>H2SO4>HClO4 | B. | 碱性:Mg(OH)2>Ca(OH)2>KOH | ||
| C. | 热稳定性:H2S>H2O>HF | D. | 氧化性:F2>Cl2>Br2>I2 |
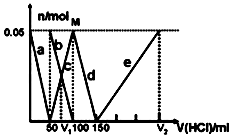 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)
| A. | a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | V1:V2=1:4 |
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料n | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积/L | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v丙 |
| A. | V甲>V乙 | B. | K丙>K乙 | C. | V甲=V丙 | D. | c乙>c甲 |
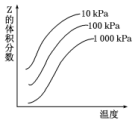 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
| A. | 同分异构体之间分子式相同,其相对分子质量也一定相等,则相对分子质量相等的物质一定是同分异构体 | |
| B. | 同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体 | |
| C. | 两种物质如果互为同分异构体,则一定不可能为同系物 | |
| D. | 两种物质如果互为同分异构体,则它们的命名可能一样 |
| A. | 石英砂可用于生产单晶硅 | |
| B. | 大多数金属在常温下是固体 | |
| C. | 可用氢氟酸在玻璃器皿上刻蚀标记 | |
| D. | 飞机机身的复合材料大多是以金属为增强体、纤维为基体的复合材料 |