题目内容
在下列各溶液中,离子一定能大量共存的是( )
| A、能与铝反应放出氢气的溶液中:K+、Al3+、Cl-、SO42- |
| B、水电离出来的c(H+)=10-12mol/L的溶液 Na+、Cl-、Br-、Ba2+ |
| C、所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
| D、室温下,pH=1的无色溶液中:Na+、Fe3+、NO3-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.能与铝反应放出氢气的溶液,为非氧化性酸或强碱溶液;
B.水电离出来的c(H+)=10-12mol/L的溶液,为酸或碱溶液;
C.离子之间相互促进水解;
D.室温下,pH=1的溶液显酸性,Fe3+为黄色.
B.水电离出来的c(H+)=10-12mol/L的溶液,为酸或碱溶液;
C.离子之间相互促进水解;
D.室温下,pH=1的溶液显酸性,Fe3+为黄色.
解答:
解:A.能与铝反应放出氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Al3+,故A不选;
B.水电离出来的c(H+)=10-12mol/L的溶液,为酸或碱溶液,酸或碱溶液中该组离子之间不反应,可大量共存,故B选;
C.CO32-、Al3+离子之间相互促进水解生成沉淀和气体,不能大量共存,故C不选;
D.室温下,pH=1的溶液显酸性,离子之间不反应可共存,但Fe3+为黄色,与无色溶液不符,故D不选;
故选B.
B.水电离出来的c(H+)=10-12mol/L的溶液,为酸或碱溶液,酸或碱溶液中该组离子之间不反应,可大量共存,故B选;
C.CO32-、Al3+离子之间相互促进水解生成沉淀和气体,不能大量共存,故C不选;
D.室温下,pH=1的溶液显酸性,离子之间不反应可共存,但Fe3+为黄色,与无色溶液不符,故D不选;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重水解及复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
 为了保持注水肉的色泽和水分,不法商赈向猪体内加入含有沙丁胺醇(如图)的胶类物质,该物质对人体危害很大,关于该物质以下说法不正确的是( )
为了保持注水肉的色泽和水分,不法商赈向猪体内加入含有沙丁胺醇(如图)的胶类物质,该物质对人体危害很大,关于该物质以下说法不正确的是( )| A、该物质属于芳香族化台物 |
| B、在一定条件下可发生取代反应和加成反应 |
| C、1mol该有机物与足量钠反应生成3NA个H2分子 |
| D、该有机物的分子式为C3H21NO3 |
下列有关说法正确的是( )
| A、标准状况下,33.6L HF中含有氟原子的数目为1.5NA |
| B、1L 0.1mol/L的碳酸钠溶液中的阴离子总数等于0.1NA |
| C、30g SiO2中有0.5NA个[SiO4]四面体 |
| D、某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
XeF4在水中的反应为:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列说法中正确的是( )
| A、XeF4分子中各原子均达到8电子稳定结构 |
| B、XeF4分子中Xe的化合价为0价 |
| C、上述反应中氧化剂和还原剂的物质的量之比为2:3 |
| D、XeF4按上述方式水解,每生成4mol Xe,转移16mol电子 |
化学实验是科学探究过程中的一神重要方法.下列有关实验的说法正确的是( )
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
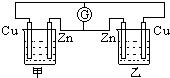 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
已知有反应:Cu2O+2H+→Cu+Cu2++H2O,则可用来检验氢气还原CuO所得的红色固体中是否含Cu2O的试剂是( )
| A、稀硝酸 | B、稀硫酸 |
| C、盐酸 | D、浓硫酸 |