题目内容
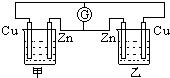 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲乙都为原电池装置,锌比铜活泼,为原电池的负极,铜为正极,原电池工作时,正极发生还原反应,氢离子得电子被还原生成氢气,负极发生氧化反应,锌失电子氧化生成锌离子,以此解答该题.
解答:
解:A.两电源并联,电路中有电流产生,电流计G的指针偏转,故A错误;
B.电子由负极经导线流向正极,即流动方向是由下向上,故B正确;
C.两个装置都是原电池装置,故C正确;
D.两个装置相同,铜为正极,发生还原反应,生成氢气,且氢离子浓度减小,故D正确.
故选A.
B.电子由负极经导线流向正极,即流动方向是由下向上,故B正确;
C.两个装置都是原电池装置,故C正确;
D.两个装置相同,铜为正极,发生还原反应,生成氢气,且氢离子浓度减小,故D正确.
故选A.
点评:本题综合考查原电池、电解池知识,为高频考点,侧重于电化学基础知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、30g SiO2含有NA个Si-O共价键 |
| B、1L 0.2mol?L-1 Al2(SO4)3溶液中的离子总数为NA |
| C、标准状况下,22.4L H2O所含原子个数大于3NA |
| D、含4mol HCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA |
下列各变化中属于原电池反应的是( )
①在空气中金属铝表面迅速氧化形成保护层
②镀锌铁表面有划损时,仍然能阻止铁被氧化
③红热的铁丝与冷水接触,表面形成蓝黑色保护层
④锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快.
①在空气中金属铝表面迅速氧化形成保护层
②镀锌铁表面有划损时,仍然能阻止铁被氧化
③红热的铁丝与冷水接触,表面形成蓝黑色保护层
④锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快.
| A、只有②④ | B、只有④ |
| C、只有②③④ | D、只有①②④ |
在下列各溶液中,离子一定能大量共存的是( )
| A、能与铝反应放出氢气的溶液中:K+、Al3+、Cl-、SO42- |
| B、水电离出来的c(H+)=10-12mol/L的溶液 Na+、Cl-、Br-、Ba2+ |
| C、所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
| D、室温下,pH=1的无色溶液中:Na+、Fe3+、NO3-、SO42- |
下列有关离子方程式正确的是( )
| A、向稀盐酸中加入少量钠粒:2Na+2H2O═2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O═Fe(OH)3↓+3Al(OH)3↓ |
| C、用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O═Al(OH)3↓+Mg2+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1 mol?L-1 Fe(NO3)2溶液:Mg2+、H+、SO42-、Cl- |
| B、0.1 mol?L-1 Ag(NH3)2OH溶液:Na+、H+、Cl-、NO3- |
| C、与金属铝能产生大量H2的溶液:K+、Na+、HCO3-、NO3- |
| D、c(H+)+c(OH-)=2×10-7mol?L-1的溶液:K+、Na+、Br-、Cl- |
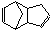 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.