题目内容
下列有关说法正确的是( )
| A、标准状况下,33.6L HF中含有氟原子的数目为1.5NA |
| B、1L 0.1mol/L的碳酸钠溶液中的阴离子总数等于0.1NA |
| C、30g SiO2中有0.5NA个[SiO4]四面体 |
| D、某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,氟化氢的状态不是气体,不能使用标况下的气体摩尔体积计算氯化氢的物质的量;
B.碳酸钠溶液中,碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致阴离子数目增多;
C.30g二氧化硅的物质的量为0.5mol,每个硅原子形成1个[SiO4]四面体;
D.氮气与氢气生成氨气的反应为可逆反应,氨气不可能完全转化成氨气.
B.碳酸钠溶液中,碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致阴离子数目增多;
C.30g二氧化硅的物质的量为0.5mol,每个硅原子形成1个[SiO4]四面体;
D.氮气与氢气生成氨气的反应为可逆反应,氨气不可能完全转化成氨气.
解答:
解:A.标况下,氟化氢不是气体,不能使用标况下的气体摩尔体积计算33.6L氟化氢的物质的量,故A错误;
B.1L 0.1mol/L的碳酸钠溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子水解,导致阴离子数目增多,所以溶液中含有的阴离子的物质的量大于0.1mol,阴离子总数大于0.1NA,故B错误;
C.每个[SiO4]四面体中含有1个硅原子,30g二氧化硅的物质的量为0.5mol,0.5mol硅原子能够形成0.5mol[SiO4]四面体,含有0.5NA个[SiO4]四面体,故C正确;
D.密闭容器中盛有0.1mol N2和0.3mol H2,该反应为可逆反应,生成氨气的物质的量小于0.2mol,在一定条件下充分反应,转移的电子的物质的量小于0.6mol,转移电子的数目小于0.6NA,故D错误;
故选C.
B.1L 0.1mol/L的碳酸钠溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子水解,导致阴离子数目增多,所以溶液中含有的阴离子的物质的量大于0.1mol,阴离子总数大于0.1NA,故B错误;
C.每个[SiO4]四面体中含有1个硅原子,30g二氧化硅的物质的量为0.5mol,0.5mol硅原子能够形成0.5mol[SiO4]四面体,含有0.5NA个[SiO4]四面体,故C正确;
D.密闭容器中盛有0.1mol N2和0.3mol H2,该反应为可逆反应,生成氨气的物质的量小于0.2mol,在一定条件下充分反应,转移的电子的物质的量小于0.6mol,转移电子的数目小于0.6NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关,选项D为易错点,注意可逆反应的特点.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、30g SiO2含有NA个Si-O共价键 |
| B、1L 0.2mol?L-1 Al2(SO4)3溶液中的离子总数为NA |
| C、标准状况下,22.4L H2O所含原子个数大于3NA |
| D、含4mol HCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA |
下列实验装置能达到实验目的是( )
A、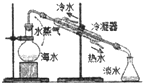 海水蒸馏 |
B、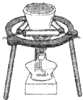 钾在空气中的燃烧 |
C、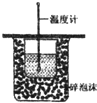 测定中和热 |
D、 牺牲阳极的阴极保护法 |
某有机物M的结构简式如图所示,下列有关叙述正确的是( )


| A、1mol M最多可以与2mol Br2发生反应 |
| B、M在一定条件下可以发生消去反应、取代反应和加成反应 |
| C、一个M分子中最多有8个碳原子在同一平面上 |
| D、1mol M与足量的NaOH溶液反应,最多可以消耗3mol NaOH |
已知pH表示溶液中c(H+)的负对数,同样也可以定义pOH表示溶液中c(OH-)的负对数,即pOH=-lg(OH-),温度T时水的离子积常数用KW表示,则此温度下不能判定溶液呈中性的依据是( )
A、
| ||
B、pOH=-lg
| ||
| C、c(H+)=10-pOH | ||
D、pH+pOH=lg
|
下列各变化中属于原电池反应的是( )
①在空气中金属铝表面迅速氧化形成保护层
②镀锌铁表面有划损时,仍然能阻止铁被氧化
③红热的铁丝与冷水接触,表面形成蓝黑色保护层
④锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快.
①在空气中金属铝表面迅速氧化形成保护层
②镀锌铁表面有划损时,仍然能阻止铁被氧化
③红热的铁丝与冷水接触,表面形成蓝黑色保护层
④锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快.
| A、只有②④ | B、只有④ |
| C、只有②③④ | D、只有①②④ |
在下列各溶液中,离子一定能大量共存的是( )
| A、能与铝反应放出氢气的溶液中:K+、Al3+、Cl-、SO42- |
| B、水电离出来的c(H+)=10-12mol/L的溶液 Na+、Cl-、Br-、Ba2+ |
| C、所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
| D、室温下,pH=1的无色溶液中:Na+、Fe3+、NO3-、SO42- |



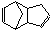 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.