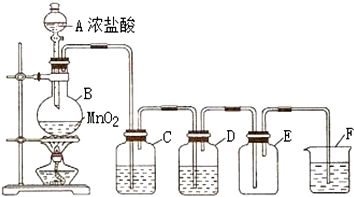
题目内容
6.两种气态烃共0.1mol,完全燃烧后得3.584L(标准状况)二氧化碳和一定量的水,下列说法中正确的是( )| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有甲烷 | D. | 一定没有乙烯 |
分析 标况下3.584L二氧化碳的物质的量为:n(CO2)=$\frac{3.584L}{22.4L/mol}$=0.16mol,根据混合物的物质的量,求出混合的平均化学式,然后结合选项分析.
解答 解:标况下3.584L二氧化碳的物质的量为:n(CO2)=$\frac{3.584L}{22.4L/mol}$=0.16mol,两种气态烃共0.1mol,则混合烃的平均化学式C1.6Hn,由于是混合物,则肯定含有C原子数小于1.6的烃,即一定含有甲烷,故B正确;
故选B.
点评 本题考查了有机物分子式确定,题目难度不大,注意掌握利用平均分子组成判断烃的组成的方法,侧重于考查学生的分析能力和计算能力

练习册系列答案
相关题目
14.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
1.在短周期元素中,属于非金属元素的有( )
| A. | 9种 | B. | 11种 | C. | 13种 | D. | 15种 |
11.下列关于烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键;
②烷烃中除甲烷外,很多都能使高锰酸钾溶液的紫色褪去;
③分子通式为CnH2n+2的烃不一定是烷烃;
④所有的烷烃在光照条件下都能与氯气发生取代反应;
⑤光照条件下,乙烷通入氯水中,可使氯水褪色.
①在烷烃分子中,所有的化学键都是单键;
②烷烃中除甲烷外,很多都能使高锰酸钾溶液的紫色褪去;
③分子通式为CnH2n+2的烃不一定是烷烃;
④所有的烷烃在光照条件下都能与氯气发生取代反应;
⑤光照条件下,乙烷通入氯水中,可使氯水褪色.
| A. | ①③⑤ | B. | ②③ | C. | ①④ | D. | ①②④ |
18.下列说法正确的是( )
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 任何化学物质中均存在化学键 | |
| D. | 全部由非金属元素形成的化合物一定是共价化合物 |
 .
.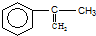 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: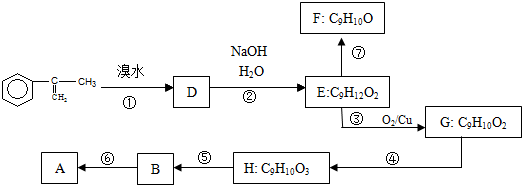
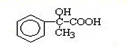
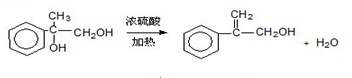 .两分子H之间发生反应生成六元环酯化学方程式是:2
.两分子H之间发生反应生成六元环酯化学方程式是:2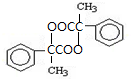 +2H2O.
+2H2O.
 .
.