题目内容
4.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
分析 四种主族元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,则原子序数大小顺序是:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期.在同一周期元素中随着原子序数的增大,元素的非金属性增强、金属性减弱,而元素的金属性越强,其最高价氧化物的水化物碱性越强.而电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:四种主族元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,则原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期.
A.Z、R为同一周期的非金属元素,且元素的原子序数c>d,在同一周期元素非金属性从左向右在增强,即非金属性Z>R,故A错误;
B.由上述分析可知,元素的原子序数为a>b>c>d,故B错误;
C.离子电子层结构相同,而Y的核电荷数大于Z的,故离子半径:离子半径bYn+<cZn-,故C正确;
D.X、Y为金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,故D错误.
故选C.
点评 本题考查结构性质位置关系元素,关键明确元素在周期表中的相对位置,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
14.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
12.一个外围电子构型为2s22p5的元素,下列有关它的描述正确的有( )
| A. | 原子序数为7 | B. | 周期表中第一电离能最小 | ||
| C. | 周期表中原子半径最大 | D. | 周期表中电负性最大 |
19.假设反应N2+3H2?2NH3(正反应为放热反应) 的正反应速率是v1,逆反应速率是v2,当升高温度时,v1和v2的变化情况为( )
| A. | 同时增大 | B. | v1减小,v2增大 | C. | 同时减小 | D. | v1增大,v2减小 |
9.根据系统命名法,对烷烃 的命名正确的是( )
的命名正确的是( )
 的命名正确的是( )
的命名正确的是( )| A. | 2,4二甲基2乙基己烷 | B. | 3,5,5三甲基庚烷 | ||
| C. | 3,3,5三甲基庚烷 | D. | 3,3,5三甲基-庚烷 |
13.苯环结构中不存在碳碳双键,而是一种介于单键和双键之间的结构,下列不可以作为事实依据的是( )
| A. | 苯不能使酸性KMnO4溶液褪色 | |
| B. | 苯不能使溴水因发生化学反应而褪色 | |
| C. | 苯在加热和有催化剂存在条件下与H2反应生成环己烷 | |
| D. | 邻二氯苯只有一种结构 |
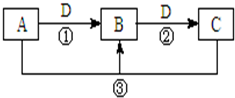 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空: